本研究は、ATP刺激によって生じる血管内皮細胞Ca2+上昇反応の開始点とカベオリン分布との関連を、共焦点レーザー顕微鏡を用いたCa2+イメージングと免疫蛍光染色を組み合わせて検討したものであり、下記の結果を得ている。 1.ATP(500nM)存在下でのメディウムの流れによって内皮細胞[Ca2+]iは上昇した。その上昇パターンはbiphasic(60%),oscillatory(32%),transient(6%)と細胞ごとに異なっていた。どの反応パターンにおいても反応直後のスパイクを形成するCa2+上昇は細胞辺縁の限局した固有の部位から始まり、Ca2+waveとして細胞全体へと約30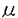 m/sの速度で伝搬した。この反応はATP非存在下では生じなかったこと、ATPスカベンジャーであるapyraseやP2受容体阻害薬であるsuraminで完全に消失したこと、流れの方向を変えたり細胞外Ca2+を除去した場合にも同一部位からCa2+waveが発火・伝播したことより、ATP分子がP2受容体と結合した結果細胞内Ca2+ストアから動員されたものであると考えられた。 m/sの速度で伝搬した。この反応はATP非存在下では生じなかったこと、ATPスカベンジャーであるapyraseやP2受容体阻害薬であるsuraminで完全に消失したこと、流れの方向を変えたり細胞外Ca2+を除去した場合にも同一部位からCa2+waveが発火・伝播したことより、ATP分子がP2受容体と結合した結果細胞内Ca2+ストアから動員されたものであると考えられた。 2.ATPと同様にG蛋白・PLCを介して細胞内IP3上昇をきたすアゴニストであるbradykininは、ATP刺激の場合と同一部位からCa2+waveを発火させた。対照的に、IP3上昇を介さないA23187やthapsigarginで刺激した場合には特定の発火部位やCa2+waveは認められず、[Ca2+]iは比較的緩徐に、細胞全体でほぼ均一に上昇した。さらに、IP3受容体阻害薬であるheparinを細胞内注入することによりCa2+上昇は抑制された。これらの所見より、Ca2+waveの発火と伝播はIP3による細胞内Ca2+の動員によるものであることが示された。 3.Ca2+イメージングを行った細胞に対してカベオリンに対する免疫蛍光染色を行った。その結果、カベオリンは細胞辺縁の一部に強く発現する傾向があり、このカベオリン集中部位よりCa2+waveが発火した。GFP-カベオリンのキメラ遺伝子を導入した細胞においてもCa2+waveは辺縁に強く発現したGFP-カベオリン集中部位から発火した。他方、初期エンドゾームのマーカーである細胞内に取り込まれたFITC標識トランスフェリンや、クラスリンに関連するアダプター蛋白のサブユニット(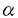 -adaptin、 -adaptin、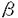 1/ 1/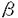 2-adaptin)の分布は細胞全体に比較的均一に分布しており、カベオリン分布はCa2+waveの発火部位の決定により重要な因子である事が示唆された。 2-adaptin)の分布は細胞全体に比較的均一に分布しており、カベオリン分布はCa2+waveの発火部位の決定により重要な因子である事が示唆された。 4.カベオリン分布とATP刺激によって生じるCa2+waveの開始点との関係を,colcemid処置(0.1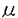 g/ml,48時間)をした細胞において検討した。細胞は円形となり、カベオリンは細胞中央へ後退・集積した。ATP刺激(3 g/ml,48時間)をした細胞において検討した。細胞は円形となり、カベオリンは細胞中央へ後退・集積した。ATP刺激(3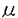 M)に対して、細胞辺縁ではなく細胞中央のカベオリン集積部の辺縁よりCa2+上昇がほぼ同時にリング状に開始した。 M)に対して、細胞辺縁ではなく細胞中央のカベオリン集積部の辺縁よりCa2+上昇がほぼ同時にリング状に開始した。 5.細胞辺縁のカベオリン集中部位は流れ存在下(shear stress:20dyn/cm2,24-48h)で細胞培養することにより流れの上流側へとシフトした。カベオリンのシフトは同時に染色したアクチン、ビンキュリン、チュブリンの分布の変化と相関する傾向は認められなかった。流れ負荷した細胞に対してATP刺激(3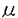 M)によって生じるCa2+waveの発火点は、上流側へシフトしたカベオリン集中部位から発火した。 M)によって生じるCa2+waveの発火点は、上流側へシフトしたカベオリン集中部位から発火した。 以上、本論文はATP刺激によって内皮細胞内Ca2+上昇が、Ca2+waveとして細胞辺縁のカベオリン集中部位から発火すること、さらにその発火部位はカベオリンの分布の変化にともなって移動しうることをはじめて明らかにした。本研究は、細胞内Ca2+シグナリングに関わるカベオラおよびカベオリンの役割の解明に重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 |