本研究は、もともとヒト胃癌からマウス線維芽細胞由来のNIH3T3細胞を形質転換する能力をもつ腫瘍遺伝子として分離同定されたHST-1/FGF-4遺伝子の遺伝子産物の機能を明らかにするため、HST-1遺伝子を組み込んだアデノウイルスをマウスに感染させる系を用いて、HST-1遺伝子産物のマウス成体での生物学的機能、生理作用の解析を試みたものであり、下記の結果を得ている。 (A)HST-1遺伝子を組み込んだアデノウイルスをマウスの腹腔内に投与し、病理組織学的、血液学的変化を経時的に検索した結果、ウイルス投与後、マウスの末梢血の血小板数の増加のみが第7日目より始まり、第10日目には正常の約2倍にまで増加し、その増加が20-30日間持続することを見出した。このマウスでは、陰性対照マウスと比較し、骨髄の巨核球の数が有意に増加していた。他に明らかな病理学的変化はなかった。また、比較的大量の組換えヒトHST-1蛋白質をマウスに投与することによっても、一過性であるが、血小板数の増加がみられたことから、HST-1蛋白質そのものがマウスにおいて血小板数を増加させる作用をもつことが示唆された。 (B)HST-1遺伝子を組み込んだアデノウイルスまたは組換えヒトHST-1蛋白質と、ヒト巨核芽球性白血病細胞株であるDami細胞、マウス骨髄の巨核球前駆細胞を用いて、HST-1蛋白質の巨核球の増殖、分化に対する作用の検討をおこなった。HST-1蛋白質が巨核球の細胞表面にあるFGF受容体を介して巨核球に直接作用し、巨核球の成熟の全ての段階(核分裂(endomitosis)、細胞質の増大と成熟、膜の成熟、血小板の放出)を促進させること、巨核球から二次的にIL-6、TNF-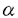 の分泌を促進させたり、巨核球と内皮細胞との接着を促進させて間接的にも巨核球の分化を促進させること、また、IL-3、c-mpl ligand(TPO)と各々相乗的に作用して巨核球前駆細胞の増殖を促進させることが示唆された。 の分泌を促進させたり、巨核球と内皮細胞との接着を促進させて間接的にも巨核球の分化を促進させること、また、IL-3、c-mpl ligand(TPO)と各々相乗的に作用して巨核球前駆細胞の増殖を促進させることが示唆された。 (C)現在までのところ、癌に対する化学療法剤や放射線照射による重大な副作用の1つである血小板減少症に対しての有効な治療法はないので、HST-1遺伝子を組み込んだアデノウイルスの投与によって、血小板減少症を予防あるいは治療できるかを検討した。化学療法剤の投与や放射線照射の組み合わせによって血小板減少症をおこさせたマウスに対し、あらかじめHST-1遺伝子を組み込んだアデノウイルスを投与しておくと、血小板数減少の程度は対照群に比べ有意に軽減され、血小板数減少の期間も短縮された。また、HST-1遺伝子を組み込んだアデノウイルスを投与されたマウスでは骨髄の巨核球の数、大きさが増加していた。すなわちHST-1遺伝子を組み込んだアデノウイルスの投与によって骨髄の巨核球の増殖、成熟が促進された結果、血小板の産生が増加し、血小板減少の状態から速やかに回復したことが示唆された。次に、HST-1遺伝子を組み込んだアデノウイルスとTPOを併用投与することにより、単独投与よりも強力な血小板数の回復促進作用が得られることがわかった。この併用群のマウスの骨髄では、対照群と比べて巨核球前駆細胞コロニーの有意な増加を認めた。すなわち、HST-1蛋白質とTPOの相乗効果によって、より強力な巨核球前駆細胞増殖効果が得られ、ひいては血小板産生促進作用により血小板減少症に対してより強力な予防、治療効果が得られる可能性が示唆された。 以上、本論文はHST-1遺伝子を組み込んだアデノウイルスをもちいて、HST-1蛋白質がマウス成体において血小板数増加作用をもつこと、さらに巨核球の増殖、分化を促進することを明らかにした。またHST-1遺伝子を組み込んだアデノウイルスは化学療法や放射線照射による血小板減少症の有効な予防法、治療法となる可能性が示唆された。本研究は、これまで未知であった、HST-1/FGF-4遺伝子産物の機能の解明に重要な貢献をなすと考えられ、また現在治療法のない血小板減少症に対する遺伝子治療の発展にも寄与する可能性をもつと思われ、学位の授与に値すると考えられる。 |