| 内容要旨 | | はじめに アデノシン三リン酸(ATP)は、神経伝達物質やパラクリン、オートクリン様生理活性物質として細胞膜上のプリン受容体に作用し、細胞間の情報伝達において重要な役割を担うことが近年明らかとなっている。プリン受容体は、アデノシンやAMPをアゴニストとするP1受容体と、ATP,ADPをアゴニストとするP2受容体に大別される。P2受容体の中には、ATP,ADPよりも、UTP,UDPに対してより高い親和性を示すサブタイプが知られている。このため、P2受容体はヌクレオチド受容体とも呼ばれている。P2受容体は、従来、主として薬理学的解析に基づいて、P2X,P2Y,P2U,P2T,P2Zの5種に分類されてきた。P2受容体は心血管、中枢神経、消化管、内分泌、免疫系など生体の広範な組織に分布して多彩な機能を有している。しかしP2受容体に対する、特異的な作動薬、拮抗薬、放射性リガンドのないことや、作動薬であるヌクレオチドの不安定性などが障害となり、重要な機能的意義を有しているにもかかわらず、その役割は十分に解明されていなかった。血管系において、ヌクレオチドは複数種のP2受容体を介して、収縮・弛緩、増殖に関与していると考えられてきた。たとえば、ヌクレオチドによる血管の収縮・弛緩反応については、ATPは、血管平滑筋のP2X受容体を介して収縮を引き起こし、一方、内皮のP2Y受容体を介して内皮依存性の弛緩を引き起こすと考えられていた。しかし、ATP以外にもADPやUTP、またジアデノシンポリリン酸といった特殊なヌクレオチドも血管平滑筋の収縮や内皮依存性の弛緩を引き起こすことが報告され、血管壁におけるP2受容体のサブタイプの分布やそれらの役割はかなり複雑であることが予測されている。最近になり、ラットP2U及びニワトリP2Y(共にG蛋白共役型受容体)、ラットP2X(カチオンチャンネル受容体)が相次いでクローニングされた。それらの知見に基づき、P2受容体を、イオンチャンネル型(P2X)とG蛋白共役型(P2Y)の2種類に大別する新しい分類が提唱されている。 我々は血管平滑筋に発現するP2受容体の構造と機能を明らかにする目的で、ラット大動脈平滑筋細胞cDNAライブラリーをスクリーニングした。その結果、新しいG蛋白共役型P2受容体(P2Y6)のcDNAをクローニングすることができた。この受容体は、これまでの薬理学的な解析からは存在が予測されなかった全く新しいヌクレオチドアゴニストプロフィールを示すサブタイプであることが判明し、共役する細胞内情報伝達機構において他のP2受容体とは異なる特徴を有していた。 方法1.ラットP2Y6受容体のクローニング G蛋白共役型P2受容体としてすでにクローニングされていたマウスP2UとニワトリP2Yの間で、相同性の高い第3膜貫通領域の一部をコードするオリゴデオキシヌクレオチドを合成し、これをプローブとして、ラット大動脈平滑筋細胞の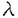 gt10cDNAライブラリーをプラークハイブリダイゼーション法によりスクリーニングした。全長をコードする約2.0kbのクローン(P2Y6)を単離した。ラット大動脈平滑筋細胞ライブラリーからは、P2Y2(=P2U)受容体もクローニングされた。また同じプローブを用いてウシ大動脈内皮細胞の gt10cDNAライブラリーをプラークハイブリダイゼーション法によりスクリーニングした。全長をコードする約2.0kbのクローン(P2Y6)を単離した。ラット大動脈平滑筋細胞ライブラリーからは、P2Y2(=P2U)受容体もクローニングされた。また同じプローブを用いてウシ大動脈内皮細胞の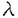 gt10cDNAライブラリ-から、ウシP2Y1(=P2Y)受容体のcDNAがクローニングされた。 gt10cDNAライブラリ-から、ウシP2Y1(=P2Y)受容体のcDNAがクローニングされた。 2.トランスフェクション P2受容体のcDNAを発現ベクターpME18SのSR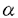 プロモーターの下流に連結し、カルシウム-リン酸法により、内因性P2受容体を発現しないラットグリオーマC6-15細胞にトランスフェクションした。二日後に実験に用いた。また、G418で選択し、安定形質発現株を得た。 プロモーターの下流に連結し、カルシウム-リン酸法により、内因性P2受容体を発現しないラットグリオーマC6-15細胞にトランスフェクションした。二日後に実験に用いた。また、G418で選択し、安定形質発現株を得た。 3.細胞内カルシウム測定 細胞をトリプシンで遊離細胞とした後、カルシウム感受性蛍光色素fura-2を封入し、340nmと380nmの波長光で励起して500nmの蛍光を測定した。その強度の比から細胞内カルシウム濃度を計算した。 4.イノシトールリン酸の測定 細胞を[3H]イノシトールで標識した後、10mMLiCl存在下に種々のヌクレオチドで60分間刺激した。10%過塩素酸で反応を停止後、AG1-X8カラムでイノシトール1リン酸、2リン酸、3リン酸を含むフラクションを分離し、その放射活性の総量をカウントした。 5.MAPキナーゼ活性化の測定(1)ERK活性化の測定 抗ERK抗体でウェスタンブロットを行い、p42ERKのバンドシフトの検出により評価した。 (2)JNK活性の測定 細胞溶解物をGST-cJunセファロースビーズと混和してJNKを沈降し、[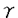 32P]ATP存在下でGST-cJunのリン酸化を測定した。 32P]ATP存在下でGST-cJunのリン酸化を測定した。 (3)p38MAPキナーゼ活性化の測定 細胞溶解物を抗p38MAP kinase抗体で免疫沈降し、[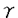 32P]ATP存在下でGST-ATF2のリン酸化を測定した。 32P]ATP存在下でGST-ATF2のリン酸化を測定した。 6.PDGF B鎖のノーザン解析 細胞から抽出した総RNAをホルムアルデヒドゲル電気泳動により泳動後、ナイロン膜に転写し、[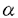 -32P]dCTPで標識したラットPDGF B鎖cDNAプローブを用い、ハイブリダイゼーションを行った。 -32P]dCTPで標識したラットPDGF B鎖cDNAプローブを用い、ハイブリダイゼーションを行った。 7.PDGF B鎖プロモーター活性の測定 PDGF B鎖プロモーター・ルシフェラーゼフュージョンベクター(Sis-Luc)を細胞にトランスフェクションし,アゴニストで刺激して4時間後に,ルシフェラーゼ活性を測定した. 結果1.ラットP2Y6受容体の構造、発現、機能 (1)P2Y6cDNAは328個のアミノ酸からなるタンパクをコードした.この蛋白はP2Y1(=P2Y),P2Y2(=P2U)と同様に、7回膜貫通構造型であった。既知のP2受容体との間に相同性を有していた(ラットP2Y2と45%、ウシP2Y1と38%)。 (2)ノーザンブロット解析によって、P2Y6mRNAの発現は、大動脈、腸管膜、肺、胃、小腸、脾、心に比較的強かった。一方P2Y2mRNAの発現はP2Y6とかなりの重複が見られたが、より広範な組織で発現を認めた。 (3)P2Y6を発現させたC6グリオーマ細胞において、ヌクレオチドはイノシトールリン酸の産生を促進し、細胞内カルシウムを上昇させた。この結果からホスホリパーゼCに共役していることがわかった。ホスホリパーゼCへの共役は百日咳毒素の前処理によっては抑制されなかった。アデニレートサイクレースへの共役は認められなかった。 (4)細胞内カルシウム増加反応を指標として、種々のヌクレオチドに対する反応を調べた。P2Y6を発現するC6グリオーマ細胞では、ヌクレオチドの活性順位はUDP>UTP>ADP>ATP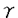 S≧ATPであった。P2Y2を発現する細胞では、UTP=ATP=ATP S≧ATPであった。P2Y2を発現する細胞では、UTP=ATP=ATP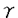 S>ADP=UDP、P2Y1を発現する細胞ではADP>ATP>>UTP,UDPであった。このようにUDPに対して高い反応性を示す点で、P2Y6受容体はP2Y1,P2Y2とは異なっていた。P2受容体のアンタゴニストとして知られるスラミン、Reactive blue-2はP2Y6受容体に対してアンタゴニストとして作用した。 S>ADP=UDP、P2Y1を発現する細胞ではADP>ATP>>UTP,UDPであった。このようにUDPに対して高い反応性を示す点で、P2Y6受容体はP2Y1,P2Y2とは異なっていた。P2受容体のアンタゴニストとして知られるスラミン、Reactive blue-2はP2Y6受容体に対してアンタゴニストとして作用した。 2.血管平滑筋細胞におけるP2Y6受容体を介する細胞内情報伝達機構とPDGF B鎖mRNAの発現作用 P2Y6受容体とP2Y2受容体を発現する血管平滑筋細胞を用いて、これらの受容体のMAPキナーゼ(ERK,JNK,p38経路)への共役及び遺伝子発現に対する作用について検討を加えた。 (1)UDPにより選択的にP2Y6を活性化すると、ERK,JNK,p38はいずれも強く活性化された。これに対して、ATP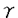 Sにより選択的にP2Y2を活性化するとERKのみが強く活性化された。 Sにより選択的にP2Y2を活性化するとERKのみが強く活性化された。 (2)P2Y6,P2Y2いずれを介するERK活性化もホルボールエステル前処理によるCキナーゼの枯渇によって強く抑制された。チロシンキナーゼ阻害剤によって、P2Y6を介するERK活性化は部分的に、P2Y2を介するERK活性化は強く抑制された。またP2Y6を介するJNK及びp38の活性化はチロシンキナーゼ阻害剤によって強く抑制された。 (3)P2Y6を介するERK活性化はアデノウィルスを用いた優性抑制型Ras変異体の発現によって抑制を受けなかったが、P2Y2を介するERK活性化は強く抑制された。P2Y6を介するJNK活性化は、優性抑制型Rac変異体の発現によって、部分的に抑制された。 (4)P2Y6の活性化によりPDGF B鎖mRNAの発現が誘導された。一方、P2Y2にはこの作用はなかった。このP2Y6によるPDGF B鎖mRNAの誘導はMEKの特異的阻害剤であるPD98059により完全に抑制された。p38阻害剤SB203580には抑制作用がなかった。UDP刺激後にPD98059を加えていくと、UDP刺激後20分まではPDGF B鎖のmRNA発現が抑制された。また,Sis-Lucと各MAPキナーゼの優性抑制型発現ベクターをコトランスフェクトした実験において,PDGF B鎖のプロモーター活性は,優性抑制型ERK及び優性抑制型JNKの発現により抑制された.優性抑制型p38には抑制作用がなかった. 考察 1.P2Y6はUDPを最強のアゴニストとするユニークなアゴニスト特性を示すG蛋白共役型P2受容体であることが明らかとなった。現在まで4種類のほ乳類G蛋白共役型P2受容体(P2Y1,P2Y2,P2Y4,P2Y6)がクローニングされている。このうちP2Y2,P2Y4,P2Y6の3種類がUTPまたはUDPに高親和性を持つことがことが明らかとなっている。一方、イオンチャンネル型P2受容体はすでに7種類がクローニングされているが、すべてATPで強く活性化され、UTP,UDPで活性化されるものはない。以上の事実は、UTP、UDPのウリジンヌクレオチドも生体における重要な情報伝達物質であり、ATPやADPなどのアデニンヌクレオチドとは別種の生理作用を担う可能性を示唆する。P2Y6は血管系及び消化管に相対的に高発現し、平滑筋組織における役割が推測される。 2.血管平滑筋細胞においてP2Y6とP2Y2はともにウリジンヌクレオチドをアゴニストとして、百日咳毒素非感受性のG蛋白質と共役して、ホスホリパーゼCを活性化したが、その後のシグナル伝達に差違が認められた。第一に、ともにCキナーゼ依存的にERKを活性化するが、P2Y2のみ低分子量G蛋白質Rasに依存した。第二に、P2Y6のみstress-activated protein kinase(SAPK)として知られるJNK(Jun N terminal kinase)及びp38MAP kinaseを強く活性化した。 G蛋白共役型受容体は複数の機構を介してMAPキナーゼカスケードを活性化することが知られている。最も研究の進んでいるERKについて、例えば、Giに共役する受容体は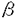 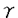 を介して、PI-3キナーゼ、チロシンキナーゼ、GRB2,Sos,Rasへとシグナルが伝達されることを示す報告がいくつかある。また、Gqに共役するタイプの受容体についてはCキナーゼ、Raf-1の経路が重要とされる一方、Cキナーゼ非依存的にチロシンキナーゼを介して、Rasの活性化を引き起こす場合も報告されている。しかし、同一の受容体サブタイプでも発現する細胞種が異なる時、異なる情報伝達機構を介して、ERKを活性化することが知られている。今回の検討から、同一細胞株において、P2受容体サブタイプ間(P2Y2とP2Y6)でERK活性化に関わる情報伝達経路が異なることが明らかとなった。また興味深いことに、P2Y2ではCキナーゼとRasの両者に対する依存性が観察された。 を介して、PI-3キナーゼ、チロシンキナーゼ、GRB2,Sos,Rasへとシグナルが伝達されることを示す報告がいくつかある。また、Gqに共役するタイプの受容体についてはCキナーゼ、Raf-1の経路が重要とされる一方、Cキナーゼ非依存的にチロシンキナーゼを介して、Rasの活性化を引き起こす場合も報告されている。しかし、同一の受容体サブタイプでも発現する細胞種が異なる時、異なる情報伝達機構を介して、ERKを活性化することが知られている。今回の検討から、同一細胞株において、P2受容体サブタイプ間(P2Y2とP2Y6)でERK活性化に関わる情報伝達経路が異なることが明らかとなった。また興味深いことに、P2Y2ではCキナーゼとRasの両者に対する依存性が観察された。 P2Y6の活性化は、PDGF B鎖遺伝子の発現を強く誘導した。このPDGF B鎖の発現誘導はMEKの特異的阻害剤であるPD98059により完全に抑制されたことにより、少なくともERKの活性化が必要と考えられる。しかし、P2Y2受容体の活性化やLPA刺激ではERKが活性化されるにもかかわらず,PDGF B鎖遺伝子の発現誘導が起きなかったことから、ERKの活性化のみでは不十分の可能性がある。UDP刺激後にPD98059を加えて、PDGF B鎖の発現を検討した実験からERKの持続的活性化が必要であることが示された。またPDGF B鎖プロモータールシフェラーゼベクターを用いた実験からERKの活性化とともにJNKの活性化も重要な因子となっていることが示唆される。同一の効果器に共役しているようにみえる受容体サブタイプも独自の複雑な情報伝達系を駆使して、その生理的機能を果たしていると考えられる。 結論 新しいG蛋白共役型受容体、P2Y6、のcDNAをラット大動脈平滑筋細胞よりクローニングした。この受容体は他のG蛋白共役型P2受容体とともにホスホリパーゼCを活性化するが、アゴニスト特異性、組織分布、MAP kinase経路への共役などにきわめて特徴的な性質を持つことが明らかとなった。さらに、平滑筋に対する増殖、遊走活性を有するPDGF B鎖の遺伝子発現を活性化することがわかった。P2Y6はこのような作用を介して、血管トーヌスの調節、血管平滑筋細胞の増殖・分化、遺伝子発現の制御などに独自の役割を担うと考えられる。血管壁に存在するP2受容体の生理的意義を明らかにする上で、受容体サブタイプの個々の生理的役割をさらに検討するとともに、アゴニストである細胞外ヌクレオチドの由来について探ることが、今後の課題である。 |