学位論文要旨
| No | 113695 | |
| 著者(漢字) | 竹尾,暁 | |
| 著者(英字) | Takeo,Satoru | |
| 著者(カナ) | タケオ,サトル | |
| 標題(和) | 熱帯熱マラリア原虫ミトコンドリア複合体II(コハク酸ユビキノン酸化還元酵素:フマル酸還元酵素)の解析 | |
| 標題(洋) | Molecular characterization of the mitochondrial complex II(succinate-ubiquinone oxidoreductase:fumarate reductase)from Plasmodium falciparum | |
| 報告番号 | 113695 | |
| 報告番号 | 甲13695 | |
| 学位授与日 | 1998.03.30 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(保健学) | |
| 学位記番号 | 博医第1356号 | |
| 研究科 | 医学系研究科 | |
| 専攻 | 国際保健学専攻 | |
| 論文審査委員 | ||
| 内容要旨 | マラリアは、単細胞真核生物であるマラリア原虫がハマダラ蚊によって媒介され、宿主赤血球内に寄生、発症する。現在最も重大な熱帯感染症であり、特有の熱発作とそれに続く貧血、脾腫が主な症状である。現在、クロロキンなど多くの化学療法剤は、耐性原虫株の出現により適用可能地域が狭められている。この原因は、これら化学療法剤の作用機構が不明なためであり、これは結局、原虫の生物学的解析によるほ乳類宿主との相違点の解明が未だ進んでいないためである。このような観点から、真核生物のエネルギー代謝を担うミトコンドリアにおけるマラリア原虫の特徴を解明することは、その生物学的解析の重要な課題のひとつである。赤血球内型原虫のミトコンドリアは、クリステが発達していないこと、その数は細胞あたり1〜数個であること、さらに赤血球内型原虫のモデルと考えられている熱帯熱マラリア原虫の培養では低酸素条件が必要であることから、ほ乳類に典型的な好気的ミトコンドリアとは異なっていると考えられる。実際にこれまで原虫ミトコンドリアにはTCA回路が存在せず、エネルギー代謝への寄与もないとされてきたが、培養のためのヒト血液の供給など大量の原虫を得ることが困難であり、分画手法が確立されていないこともあいまって、原虫ミトコンドリアの詳細な生化学的解析は行われていなかった。しかし近年、ミトコンドリア遺伝子に呼吸鎖電子伝達系酵素の一部のサブユニットがコードされていること、陽性荷電した蛍光色素によりミトコンドリアが膜電位を持つことが明らかにされるなど、ミトコンドリアが原虫のエネルギー代謝に関与していることを示唆する結果が報告される様になってきた。一方、TCA回路や電子伝達系などミトコンドリアを構成する酵素の多くは核にコードされているが、これらの酵素に関する分子生物学的研究は、ほとんど行われていない。このなかで、電子伝達系酵素複合体IIは、ミトコンドリアにのみ存在するマーカー酵素であり、ほ乳類等の好気的ミトコンドリアではTCA回路の酵素としても機能し、ミトコンドリアの2つの主要な系を直接つなぐ役割を担っている。複合体IIは生物種を問わず4つのサブユニットから構成されている(Fig.1)。比較的親水性が高くFADを共有結合しているFp、3種の鉄硫黄クラスターを含むIpサブユニットにより、コハク酸から親水性の人工的電子受容体(DCIP)への電子伝達の触媒部位であるコハク酸脱水素酵素(SDH)、もしくは反対に還元型メチルピオロジェン(MV)からフマル酸への電子伝達の触媒能を持つフマル酸還元酵素(FRD)が形成される。また、疎水性の高いシトクロムb成分は、触媒部位の膜への結合と、膜中の生理的な電子受容/供与体であるキノンとの電子伝達に必要である。マラリア原虫の赤血球期においては、これまでの組織化学的解析では、複合体II活性が検出されていなかったが、最近のFryらのミトコンドリア分画の試みによる生化学的解析では複合体IIが機能しうることが示唆されている。複合体IIは、ほ乳類宿主ではSDHとして機能するのに対し、嫌気的条件下に生息する寄生性線虫成虫などではFRDであることが知られており(Fig.1)、低酸素条件下にあると考えられている赤血球内型原虫で、複合体IIの生理的な役割を解析するためには、触媒反応の方向性を含め、その特徴を明らかにすることが重要である。私は、この複合体IIについて分子レベルで解析を進めることによりその機能の解明に到ることを計画し、修士課程では熱帯熱マラリア原虫の2つの触媒サブユニット(Fp、Ip)の遺伝子を単離し、一次構造を解析した。その結果、ミトコンドリアへの移行シグナルや前駆体タンパク質のプロセシングモチーフと考えられる部位が存在し、また成熟ペプチドの、配列既知の他種との比較では、機能発現に重要なアミノ酸(領域)はよく保存されている一方、マラリア原虫に特異的な配列も存在していることを見いだした。 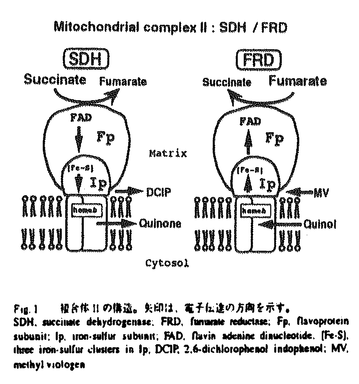 しかし、先に述べたように原虫ミトコンドリア調製は困難である。そこで本研究では、先に解析された遺伝子のコピー数と染色体上のマッピング、およびアイソフォームの存在可能性について調べた。さらに組み換えタンパクを用いて作成した抗体による解析から、複合体IIが実際に赤血球内型原虫において発現され、しかもミトコンドリアと考えられる粒子状のオルガネラに局在していることが明らかになった。 培養した熱帯熱マラリア原虫(FCR3、K1株)からゲノムDNAを抽出し、制限酵素処理の後、サザンハイブリダイゼイションを行った。プローブは先に解析したゲノム配列から作成した。その結果、プローブ内外の酵素認識部位の分布に一致したシグナルのみが得られた。これらシグナルの一部は、配列保存性が低いと考えられる非コード領域も含んでおり、ハイブリダイゼーションで予想された数のシグナルのみが得られたことから、サブユニットは各々1コピーの遺伝子として存在することが強く示唆された。 また、ハイブリダイゼーションの条件を緩くしても(65℃→50℃)、全く同じ結果が得られた。さらに、既知の複合体II(FpまたはIp)一次配列間で極めてよく保存されている部位より縮重型プライマーを作り、原虫ゲノムDNAを鋳型にPCRを行ったが、得られた50個以上のクローンは、すべて解析済みの原虫複合体IIと同じものであった。以上より、Fp、Ip各サブユニットにはアイソフォームは存在しないと考えられる。 次に、熱帯熱マラリア原虫(FCR3、K1株)虫体からアガロースプラグを調製し、パルスフィールドゲル電気泳動により14本の染色体を分離した。先と同じプローブを用いてサザンハイブリダイゼーションを行いFp遺伝子は10番、Ip遺伝子は12番染色体上に同定された(Fig.2)。これはまた、各遺伝子が1コピーである(1)との結論と一致する。ヒトや酵母(Saccharomyces cerevisiae)でもFp、Ip遺伝子は染色体上の異なる部位に存在することが分かっており、これは、4つのサブユニットがオペロンを構成している原核生物複合体IIと著しく異なっている。先にミトコンドリアへの移行シグナルや前駆体タンパク質のプロセシングモチーフ様の部位も見いだされたことから、原虫複合体IIは真核生物の核にコードされているミトコンドリアタンパク質に共通な成熟過程の様式に従っている、すなわち各サブユニットについて独立に転写され、細胞質内遊離リボソーム上における翻訳、ミトコンドリアへ移行が行われた後、成熟タンパク質として構成される、と考えられる。 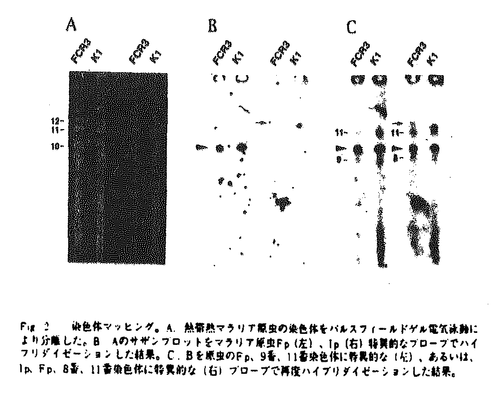 複合体IIの発現および細胞内での局在を調べるための抗体作成を目的に、熱帯熱マラリア原虫Ip配列から(前駆体タンパク質中のプロセシングモチーフと考えられる部位を参考に)成熟体全長に相当するDNAを増幅した。ペプチドのアミノ末端にヒスチジン・タグを付加する発現ベクターにこのDNA断片を組み込み、形質転換した大腸菌にIPTG誘導をかけたところ、34kDa付近に予想されたサイズのペプチドの合成が見いだされ、アミノ末端の分析により原虫Ip組み換え体の発現が確認された。これをニッケルカラムにより精製の後、ウサギを免疫して抗血清を得た。ほ乳類(ウシ)、多細胞寄生動物(回虫成虫)及び原核生物(大腸菌)の複合体IIとの交叉反応を調べた結果、ウシのIpと弱いながら明瞭な交叉反応を示したのに対し、回虫成虫、大腸菌とは反応しなかった。反対に、抗ウシ心筋Ip抗体は組み換え原虫Ipタンパクと弱い交叉反応を示した。これより、原虫Ipとほ乳類Ipでは、エピトープの配列が類似していると考えられ、実際にアミノ酸配列中に原虫とほ乳類にのみ類似している部位も見いだされた。しかし、両者はCBB染色とウェスタンブロッティングで10倍以上のシグナル強度差を示しており、原虫Ipに十分に特異的な抗体が得られたと考えられる。 培養熱帯熱マラリア原虫からtotalRNAを抽出し、さらにpolyA-RNAを精製した。先にサザン解析で用いたプローブにより、ノザンブロット解析したところ、Fpでは3.3kb、Ipでは2.4kb付近に1本のシグナルが得られた(Fig.3)。さらに、RT-PCRでOpen Reading Frame全長の半分以上の領域を解析したところ、先にFpのゲノム配列で見いだされたマラリア原虫に特異的な挿入配列を含めて、ゲノム配列と完全に一致していた。これにより、すでに解析された複合体IIのゲノム上のFp、Ip遺伝子がmRNAとして発現されており、Fp、Ipの転写物は、ともにおよそ1.5kbの非翻訳領域(UTR)を持つことが明らかになった。   g)を泳動し、ノザンプロットを原虫Fp(左)、Ip(右)特異的なプローブでハイブリダイゼーションした結果。 g)を泳動し、ノザンプロットを原虫Fp(左)、Ip(右)特異的なプローブでハイブリダイゼーションした結果。3.において調製した抗原虫Ip抗体を用いて、蛍光抗体法により原虫Ipの発現を調べた。熱帯熱マラリア原虫(FCR3、K1株)感染赤血球をスライドガラス上に塗沫し、アセトン固定の後、抗原虫Ip抗体(1:100)で37度、1時間インキュベートしたところ、(2次抗体;抗ウサギIgG(FITCラベル))特異的な蛍光が生じ、位相差像との比較により、原虫感染赤血球であることが確かめられた(Fig.4)。さらにネズミのマラリア原虫(P.yoelii)感染赤血球とも交叉反応が認められた。免疫前のウサギ血清(1:100)では特異的な蛍光は得られなかった。位相差像上の強いシグナルはヘモゾイン(マラリア色素;原虫による宿主ヘモグロビン分解の産物)であることが判明したので、少なくともヘモゾインが見いだされる後期赤血球内型原虫(後期栄養体、分裂体)において、原虫Ip、すなわち複合体IIがタンパク質として発現されていることが分かった。   m m以上、本研究で、熱帯熱マラリア原虫のミトコンドリア複合体IIの触媒部位を構成している2つの遺伝子が、核染色体上にコードされており、それぞれ1コピーであること、さらに宿主内赤血球期においてタンパク質として発現されていることが明らかとなった。これらは、マラリア原虫の核由来の呼吸鎖酵素として初めての報告である。より詳細な原虫の発育ステージ、及び原虫細胞内の局在を解析するためには、培養の際の発育ステージの同調化や、電子顕微鏡による解析が必要であり、現在進めている。ほ乳類等の好気的ミトコンドリアでTCA回路をも構成する酵素が、赤血球内型原虫で発現していることは、マラリア原虫のエネルギー代謝産生機構、とくに機能が不明であったミトコンドリアの役割を再検討させる端緒となると期待される。マラリア原虫は、宿主内赤血球期において低酸素条件下にあると考えられるが、また、無酸素では生息できないこと、ミトコンドリア内で核酸新生系のジヒドロオロト酸脱水素酵素(DHODH)からの還元力が、電子運搬体キノンを介し処理されていると考えられること、複合体Iが存在しないと考えられることなど、原虫ミトコンドリアと複合体IIについて様々な役割が考えられる(電子伝達系について、Fig.5)。このなかから原虫複合体IIの生理的な機能を特定するためには、はじめにも述べたように、触媒反応の方向性を知ることが重要である。しかしマラリア原虫のFp、Ipと、SDH/FRDそれぞれの活性を示すアイソフォームの存在が知られている他の生物種とのホモロジー検討では、結論が得られていない。そこで、原虫ミトコンドリアの調製が困難であることを考慮し、得られた2つの触媒サブユニット遺伝子の組み換え体を最終的に共発現させてその機能を解析するべく、本研究のIpに加えて現在Fp組み換え体の発現を進めている。さらに、この共発現の試みは単に、複合体IIの触媒反応の方向性を明らかにするのみならず、既存あるいは新規の複合体IIの阻害剤や、有望な抗マラリア剤の候補としてのキノン誘導体の効果、および作用様式解明にも有効であると期待される。  一方、嫌気的条件下に生息する回虫成虫などでは、I→IIの電子伝達により、ATP産生がなされ、ここで、複合体IIはFRDとして機能し、フマル酸が酸素に代わって最終的な電子受容体となる。マラリア原虫では複合体Iが存在しないことが示唆されている一方、NADHフマル酸酸化還元活性を示すデータもある。 さらに、ピリミジンのサルベーシ経路が存在しないマラリア原虫では、新生系が重要であるが、このなかの酵素DHODHから還元力も、キノンを介して電子伝達系に入ると考えられている。 | |
| 審査要旨 | 本研究は、重大な熱帯感染症であるマラリアの原因寄生虫である熱帯熱マラリア原虫(Plasmodium falciparum)と、哺乳類宿主との生物学的な相違点の解明を目的とし、真核生物のエネルギー代謝を担うミトコンドリアにその候補を求め、電子伝達系酵素でありTCA回路の酵素としても機能しているミトコンドリア複合体IIについて、以下の結果を得たものである。 (1)複合体IIを構成する4つのサブユニットのうち、2つの触媒サブユニット(Fp、Ip)の遺伝子を、単離し、一次構造を解析した(修士課程)。その結果、ミトコンドリアへの移行シグナルや前駆体タンパク質のフロセシングモチーフと考えられる部位が存在し、また成熟ペプチドの、配列既知の他種との比較から、機能発現に重要なアミノ酸(領域)は基本的に保存されている一方、マラリア原虫に特異的な欠失や挿入も存在していることを見いだした。この結果は、マラリア原虫酵素の性質が宿主哺乳類と大きく異なっている事を示唆している。 (2)(1)において解析された遺伝子のコピー数を解析するために、培養した熱帯熱マラリア原虫(FCR3、K1株)からゲノムDNAを抽出し、制限酵素処理の後、サザンハイブリダイゼイションを行った。その結果、先に解析したゲノム配列より作成したプローブ内外の酵素認識部位の分布に一致したシグナルのみが得られた。これらシグナルの一部は、配列保存性が低いと考えられる非コード領域も含んでおり、ハイブリダイゼーションで予想された数のシグナルのみが得られたことから、サブユニットは各々1コピーの遺伝子として存在することが強く示唆される。 (3)次に、パルスフィールドゲル電気泳動により14本の染色体を分離し、これら遺伝子の染色体上のマッピングを行った。(2)と同じプローブを用いてサザンハイブリダイゼーションを行い、Fp遺伝子は10番、Ip遺伝子は12番染色体上に同定された。これは、各遺伝子が1コピーであるとの(2)の結論と一致する。またこの結果は、4つのサブユニットがオペロンを構成している原核生物複合体IIと著しく異なっており、Fp、Ip遺伝子が染色体上の異なる部位に存在するヒトや酵母(Saccharomyces cerevisiae)などと同様に、真核生物複合体IIの特徴を示していた。以上の結果、および(1)において見いだされた移行シグナルなどから、原虫複合体IIの生合成過程は、真核生物の核にコードされているミトコンドリアタンパク質に共通な成熟過程の様式に従っている、すなわち各サブユニットについて独立に転写され、細胞質内遊離リボソーム上における翻訳、ミトコンドリアへ移行が行われた後に、成熟タンパク質が会合し酵素複合体が形成される、と考えられた。 (4)(2)において、ハイブリダイゼーションの条件を緩くしても(65℃→50℃)、全く同じ結果が得られた。さらに、既知の複合体II(FpまたはIp)一次配列間で極めてよく保存されている部位より作成した縮重型プライマーを用い、原虫ゲノムDNAを鋳型にPCRを行って得た50個以上のクローンは、すべて解析済みの原虫複合体IIと同じものであった。以上より、Fp、Ip各サブユニットにはアイソフォームは存在しないと考えられた。 (5)原虫複合体IIの赤血球内型原虫における発現を解析するため、培養熱帯熱マラリア原虫からRNAを抽出し、ノザンブロット解析したところ、Fpでは3.3kb、Ipでは2.4kb付近に1本のシグナルが得られた。さらに、RT PCRでOpen Reading Frame全長の半分以上の領域を解析したところ、ゲノム配列と完全に一致していた。これにより、(1)で解析されたFp、Ip遺伝子がmRNAとして発現されており、転写産物は、ともにおよそ1.5kbの非翻訳領域(UTR)を持つことが明らかになった。熱帯熱マラリア原虫のタンパク遺伝子では、長い5’UTRを持つ例がこれまでに明らかにされてきており、Fp、Ipの長いUTRもこれらと共通な生理学的意義を持つことが示唆された。 (6)さらに、複合体IIのタンパク質としての発現および細胞内での局在を調べるための抗体作成を目的に、原虫Ip配列から成熟体全長に相当するDNAを増幅した。発現ベクターにこのDNA断片を組み込み、形質転換した大腸菌を発現誘導したところ、予想されたサイズのペプチドの合成が見いだされ、アミノ末端の分析により原虫Ip組み換え体の発現が確認された。これを精製の後、ウサギを免疫して抗血清を得た。Ipは、Fpとともに保存性の高いサブユニットであるが、この抗体は原虫Ipに特異的であった。これは、原虫複合体IIの性質が宿主のそれと相当に異なっていることを示しており、(1)で明らかにされた構造上の特徴とも一致する結果であった。この抗原虫Ip抗体を用いて、蛍光抗体法により原虫Ipの発現を調べた。その結果、原虫感染赤血球に特異的な顆粒状のシグナルが観察された。さらにネズミのマラリア原虫(P.yoelii)感染赤血球にも交叉反応が認められた。位相差像上の観察から、これらのシグナルはヘモゾイン(マラリア色素;原虫による宿主ヘモグロビン分解の産物)が見いだされる後期栄養体や分裂体によるものであることが判った。つまり原虫Ip、すなわち複合体IIは後期赤血球内型原虫においてタンパク質として発現されていることが明らかになった。 以上本論文は、熱帯熱マラリア原虫ミトコンドリア複合体IIのFp、Ipサブユニット遺伝子が、核染色体上にコードされており、それぞれ1コピーであること、さらに宿主内赤血球期においてタンパク質として発現されていることを明確にしたものであり、マラリア原虫の核由来の呼吸鎖電子伝達系酵素として初めての報告である。本研究は、エネルギー代謝における役割が不明であったマラリア原虫ミトコンドリアの生理学的意義を示し、マラリア原虫の生物学的理解を進める上で極めて重要な成果と考えられる。また、宿主哺乳類酵素との構造上の相違点を見いだしたことは、化学療法の標的分子探索の観点からもこの分野の研究に大きく貢献すると評価される。よって博士(保健学)の学位に値すると判定した。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/54657 |