学位論文要旨
| No | 113696 | |
| 著者(漢字) | 秋山,卓美 | |
| 著者(英字) | ||
| 著者(カナ) | アキヤマ,タクミ | |
| 標題(和) | 植物ポリケタイド合成酵素の構造と機能の解析 | |
| 標題(洋) | ||
| 報告番号 | 113696 | |
| 報告番号 | 甲13696 | |
| 学位授与日 | 1998.03.30 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(薬学) | |
| 学位記番号 | 博薬第815号 | |
| 研究科 | 薬学系研究科 | |
| 専攻 | ||
| 論文審査委員 | ||
| 内容要旨 | 植物二次代謝産物の中には、酢酸を構成単位とする多様な構造を持ったポリケタイドと総称される化合物群が存在する。これらの化合物の基本骨格は、ポリケタイド合成酵素(polyketide synthase、PKS)による共通の縮合反応と特異的な閉環反応により形成される。例えば、カルコン骨格とスチルベン骨格は、p-coumaroyl-CoA(1)をスターターに、malonyl-CoA(2)由来のC2ユニットの伸長反応を3回行うところまで全く同じでありながら、最後の環化反応の様式の違いにより作り分けられている。古くから、植物PKSとしてカルコン合成酵素(chalcone synthase、CHS)とスチルベン合成酵素(stilbene synthase、STS)について研究が進められてきたが、反応機構に関して得られている知見は限られている。CHSやSTSなど、クローニングされている植物PKSはお互いに高い相同性があり、CHSスーパーファミリーと総称されている。これら似て異なる酵素の、タンパク構造と生成物の関係を解析することは、植物ポリケタイド合成酵素の反応機構の解明に大きく寄与するものと思われる。  アマチャ(Hydrangea macrophylla var.thunbergii)には、含有成分の構造から考えて、CHSスーパーファミリーの新たなメンバーで、中間体を閉環させず、直鎖状のテトラケチド6を遊離させる活性を持つPKSや、中間体のフォールディングはSTSと同じでありながら、脱炭酸を行わない酵素が存在すると考えられる。このようなPKSの配列が明らかになれば、前者は閉環反応、後者はSTSによる脱炭酸に関与する構造の同定に役立つと思われる。そこでまず私は、アマチャよりこのようなPKSのクローニングを検討することにした。 CHSは、伸長反応の機構の証明となる副生成物を生成させる。私は、CHSやSTSがこのほかにも副生成物を生成させ、その中には、CHSとSTSの反応機構の違いを反映したものもあると考えた。そこで大腸菌で発現させた大量の精製酵素を用いてラージスケールの反応を行い、反応副生成物を詳しく分析することにした。 目的はCHSやSTSと相同性のある酵素なので、ホモロジーを利用したPCRによるクローニングを試みた。既知のCHSおよびSTSの間で相同性の高い領域の配列をもとに、縮重入りセンスプライマーを2種、アンチセンスプライマーを2種デザインし、合成した。アマチャの葉よりtotal RNAを抽出し、逆転写して得たcDNAを鋳型にPCRを行ったところ、4種の組み合わせのいずれにおいても、予想された大きさの断片が増幅された。サブクローニングして塩基配列を決定したところ、2つのグループ、HmC、HmSのみであった。5’-RACE、3’-RACEを行い、さらにRACE産物の配列情報に基づいて全長ORFの増幅を行った。これをシークエンシングし、HmCとHmSの全長ORF、約1.2kbpの塩基配列を決定した。 HmCは、クズのCHSと86%の相同性を示し、アマチャのCHSと推測された。一方HmSは、クズのCHSと71%の相同性を示し、関連した酵素であることが考えられた。しかし、後述のHis169など、CHS、STSのコンセンサス配列と性質の異なるアミノ酸残基を持つ部分が12カ所見られ、また、他のものには見られない6残基のインサーションを有している。これらのことから、HmSは新たなPKSをコードしているものと推定された。  HmCとHmSの機能を明らかにするため、全長ORFを大腸菌で発現させて酵素活性を検討した。全長を含むPCR産物を発現ベクターpET-32aに組み込み、チオレドキシンとの融合タンパク、TrxHmC、TrxHmSとして発現させ、ヒスチジンタグを利用して融合タンパクを精製した。 酵素を1と2とともにインキュベートし、反応生成物を酢酸エチルで抽出、TLC及びHPLCで分析することにより酵素活性を検討した。TrxHmCの反応生成物中に、CHSの生成物であるnaringenin chalcone(3)が非酵素的に異性化して生成したnaringenin(7)が検出されたことから、HmCはアマチャのCHSの遺伝子であると同定できた。また、化合物A、B、Cが検出された。TrxHmSの場合、7、resveratrol(4)のいずれも検出されず、化合物A、B、Cだけが検出された。Intact HmS、酵母の系で発現させたHmSも同じ活性を示した。また、アマチャ葉より粗酵素液を調製して同様の反応を行ったところ、7の生成量が非常に低かったにもかかわらずかなりの量の化合物Aが検出され、原植物にも同じ反応を触媒する酵素が存在することが明らかになった。 化合物A、B、Cの構造を明らかにするため大量反応を行い、生成物を分取HPLCで分離・精製し、1H-NMRとMSにより構造を解析した。化合物CとBはそれぞれ、bis-noryangonin(8)とそのcisアイソマー(9)であると決定した。化合物Aは新規化合物4-hydroxy-6-[4-(4-hydroxyphenyl)-2-oxo-3-butenyl]-2H-pyran-2-oneであることが明らかになり、これを、p-coumaroyltriacetic acid lactone(10)と命名した。 In vitroアッセイで検出された8と10は、対応するカルボン酸から非酵素的にラクトン化したもので、9は8が光による異性化を受けて生成したものと考えられる。つまり、HmSタンパクは、主生成物としてp-coumaroyltriacetic acid(6)を、副生成物としてp-coumaroylacetoacetic acid(11)を生成させる酵素だと考えられる。以上のことから、HmSは閉環反応を全くせず炭素鎖伸長反応のみを触媒して直鎖テトラケチドを遊離する新しいタイプのPKSの遺伝子である事が判明した。この酵素を、coumaroyltriacetic acid synthase、CTASと命名した。炭素鎖伸長反応のみに限定されたPKSがクローニングされたのはこれが初めての例である。  酵素タンパクの構造と機能の関係を探るべく、数種のミュータント酵素を作製し、その活性を検討した。 はじめに、炭素鎖伸長反応について検討した。カラシ(Sinapis alba)由来CHSとピーナツ(Arachis hypogaea)由来STSにおいて、スターターおよび伸長鎖が結合すると推定されているCysは、HmSではCys168、HmCではCys164に対応している。Cys168をSerに改変したHmS-C168Sを作製し、酵素活性を検討したところ、全く活性を示さなかった。CHSやSTSと同様、CTASにおいても、このCys168がスターターと伸長鎖の結合部位として機能していると思われる。  次に、CHS、STSにおいて閉環反応に関与する構造、あるいは、CTASにおいて閉環を妨げている構造について検討することにした。まず、HmCとHmSを組み換えた数種のキメラタンパクを作成したところ、HmCのAla286、HmSのAla290の部分で組み換えたSC290は閉環産物を生産せず、HmSと同じCTAS活性を示した。この結果は、HmSの最大の特徴であるインサーションは閉環には関与していないこと、HmCでは閉環に関与している構造はAla286よりN末側の領域に存在することを示している。 活性中心Cysの直後のアミノ酸は、全てのCHSにおいてPhe、STSではPheまたはTyrであるのに対し、閉環を行わないCTASにおいてはHisである。そこで、部位特異的変異導入により、CHSとCTASの間でこの位置のアミノ酸を交換した、HmC-F165H、HmS-H169Fを作成した。HmC-F165Hの活性は野生型と変わらなかったが、HmS-H169Fは野生型と異なる活性を示した。期待する新たな閉環産物の生成は検出されなかったものの、トリケチドである8の生成量が2.5倍に増加し、テトラケチドである10の生成量は1/4に減少した。CTASにおいては、His169が活性中心の構造維持に関与しており、変異によりその構造が変化し、トリケチドの加水分解の反応速度が3回目の縮合の反応速度より大きくなったものと思われる。 第3章において、アマチャCHSに11と6を遊離する活性があることを見いだした。クズ(Pueraria lobata)由来のCHSとピーナツ由来のSTSについても検討したところ、これらの酵素も同じ活性を有することが明らかになった。 さらに反応生成物を精査し、他の副生成物の検出を試みた。メチル化物のGC-MSにより、STSの反応生成物中に7を検出した。次に[14C]ラベル基質を用いたキャリアー希釈法により生成物が7であることを確認した。放射活性から、STSは本来の生成物である4に対して2.3%の7を生成させる活性を持つことが明らかになった。同様にCHSの副生成物として7に対して2.7%の4が生成していることを確認した。以上のように、CHSとSTSにおいて交叉反応が生じていることが初めて証明された。この交叉性が何に基づくものなのかは現段階では不明だが、活性部位構造の柔軟さ、あるいは、タンパク合成時にCHS型、STS型の2種のコンフォーマーが生成している可能性などが考えられる。  CHSスーパーファミリーのうち主なものをもとに系統樹を作成したところ、CTASはビベンジル合成酵素(bibenzyl synthase、BBS)やアクリドン合成酵素(acridone synthase、ACS)と進化的に近いことが判明した。また、STSは独立のグループを作っていないこともわかった。これらのことと、第4章までで明らかにした酵素の性質から、CHSスーパーファミリーの分子進化の道筋を考察した。まず、スーパーファミリーの先祖はCTASと同じく閉環能力のない酵素であったと思われる。そして、CHSとSTSの直鎖テトラケチド遊離活性は、先祖の活性を完全には失っていないことを示していると思われる。この先祖型酵素が、まず閉環活性を獲得した後にACSとBBSが分化し、比較的最近になってCHSとSTSの分化が起こったと考えられる。CHSとSTSの交叉反応も、分化が完全に行われていないことの現れであると思われる。 アマチャより、炭素鎖伸長反応のみを触媒する新たなPKSのクローニングに成功し、変異酵素の解析により、酵素活性発現に関与するアミノ酸残基を同定することができた。今後は、CHS、STSとともにこのCTASを材料にして植物PKSの反応機構をさらに明らかにしていきたいと考えている。また、CHSとSTSに直鎖テトラケタイドの遊離活性があることを発見し、さらに両者の間に反応の交叉性があることを見いだした。そしてさらに、これらの性質とCHSスーパーファミリーの一次構造から植物PKSの分子進化について考察した。 今回用いたPCRによるクローニング手法はCHSスーパーファミリーの新たなメンバーのクローニングにも力を発揮すると思われ、本研究を足がかりに植物PKSの研究が急速に進展するであろう。 | |
| 審査要旨 | 植物二次代謝産物の中には、酢酸を構成単位とする多様な構造を持ったポリケタイドと総称される化合物群が存在する。これらの化合物の基本骨格はポリケタイド合成酵素(polyketide synthase、PKS)_によって形成され、炭素鎖伸長反応の回数と閉環反応の様式により多様性が生まれている。例えば、カルコン合成酵素(chalcone synthase、CHS)とスチルベン合成酵素(stilbene synthase、STS)は、伸長反応は基質、回数とも共通であるが、閉環様式が異なっている。植物PKSが共通の基質から多様な生成物を合成するメカニズム、特に生成物の作り分けに関わる閉環の反応機構は非常に興味深いが、得られている知見は限られている。一方、現在までにクローニングのなされている植物PKSはお互いに高い相同性があり、CHSスーパーファミリーと総称されている。本論文の著者は、既知のCHSやSTSと相同性があり、伸長反応は共通でありながらその後の反応のみが異なる新たなPKSのクローニングを試み、植物PKSの触媒機能に関わる構造の同定を試みた。また、CHSとSTSがin vitro反応において、その反応機構から必然的に生成させる副生成物の詳細な分析を試み、この両面から植物PKSの構造と機能の関係の解明を目指した。 アマチャ(Hydrangea macrophylla var.thunbergii)には、その含有成分の構造から考えて、CHSスーパーファミリーの新たなメンバーで、3回の伸長反応に続いて起こる反応がCHSとSTSのいずれとも異なる酵素の存在が期待されるため、そのクローニングを検討した。既知のCHSおよびSTSの間で相同性の高い領域の配列をもとにオリゴヌクレオチドプライマーをデザインし、アマチャの葉より調製したcDNAを鋳型にPCRを行ったところ、予想された大きさの断片が増幅された。塩基配列の解析から、2種のクローン、HmC、HmSの存在が判り、RACE法によりそれぞれの全長ORFを得た。そして大腸菌の発現系で機能の解析を試み、HmCはCHS、HmSは炭素鎖伸長反応のみを触媒して直鎖テトラケタイドを遊離する新たなPKS、coumaroyltriacetic acid synthase(CTAS)であることを明らかにした(Fig.1)。炭素鎖伸長反応のみを触媒するPKSがクローニングされたのはこれが初めての例である。また、その際、CTASが副生成物としてトリケタイドを生成させることも示された。また、CTASのアミノ酸配列を検討し、閉環活性を持たないこの酵素に、CHSとSTSのコンセンサス配列と一致しないアミノ酸残基が多いことが明らかになった。 次に、酵素タンパクの構造と機能の関係を探るべく、数種のミュータント酵素を作成し、その活性を検討した。はじめに、炭素鎖伸長反応について検討した。CHSとSTSにおいてスターター及び伸長鎖の結合部位である可能性の高いCysが同定されているが、アマチャCTASにおいてこれに対応するCysをSerに置換したミュータントを作製したところ、全く活性を示さなかった。CTASと既知のPKSとの共通の反応である炭素鎖伸長反応が、同じ機構で進行することを強く示唆する結果と言える。  次に、前述のCysの直後のアミノ酸が、既知のPKSではPheまたはTyrであるのに対しアマチャCTASではHisであることに着目し、部位特異的変異導入により、このHisをCHS型のPheに置換したミュータントを作成した。In vitroアッセイにおいて、トリケタイドの生成量が野生型の2.5倍に増加し、テトラケタイドの生成量は1/4に減少した。この結果より、CTASにおいてはHis169が活性中心の構造維持に関与している可能性が示唆された。 植物PKSは3回の伸長と閉環、という多段階の反応を触媒するため、各段階で生じる中間体に由来する副生成物を生成させる可能性がある。著者はまず、アマチャCHSがCTASの生成物である直鎖のトリケタイドとテトラケタイドを遊離することを見いだし、さらにクズ(Pueraria lobata)由来のCHSとピーナツ(Arachis hypogaea)由来のSTSも同じ活性を有することを明らかにした。これらの副生成物の存在は、伸長反応が段階的に起こることを証明するものである。 さらに反応生成物を精査し、他の副生成物の検出を試みたところ、STSが、スチルベンに対して2.3%のカルコンを生成させることを見いだした。同様にCHSの副生成物としてカルコンに対して2.7%のスチルベンが生成していることを確認し、CHSとSTSにおいて交叉反応が生じていることが初めて証明された(Fig.2)。この交叉性が何に基づくものなのかは現段階では明らかではないが、著者は活性部位構造の柔軟さ、あるいは、タンパク合成時にCHS型、STS型の2種のコンフォーマーが生成している可能性などを考えている。 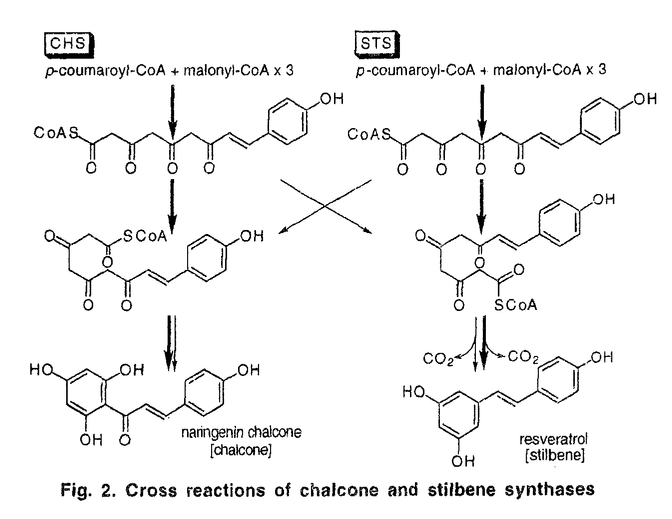 著者は、CHSスーパーファミリーのうち主なものをもとに系統樹を作成し、CTASはCHSやSTSよりも、スターターの異なる酵素の遺伝子と進化的に近いこと、STSは独立のグループを作っていないことを明らかにした。これらのことと、実験的に明らかにした酵素の性質から、CTASがCHSスーパーファミリーの先祖と近い酵素であること、CHSとSTSの交叉反応は分化が完全に行われていないことの現れであることなど、興味深い仮説を提案している。 以上、本研究において著者は、炭素鎖伸長反応のみを触媒する新たなPKSのクローニングに成功し、変異酵素の解析により、酵素活性発現に関与するアミノ酸残基を同定した。また、CHSとSTSに直鎖トリケタイド及びテトラケタイドの遊離活性があることを発見し、さらに両者の間に反応の交叉性があることを見いだした。いずれも、植物PKSの構造と反応機構を考える上で重要な知見と言える。また、今回用いたPCRによるクローニング手法はCHSスーパーファミリーの新たなメンバーのクローニングにも力を発揮すると思われ、本研究を足がかりに植物PKSの研究の急速な進展が期待できる。このように本研究は天然物化学に寄与するところが大きく、博士(薬学)の学位に値する研究であると認めた。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/54658 |