オキシドスクアレン閉環酵素によって触媒されるオキシドスクアレンの環化反応は自然界における一段階の酵素反応としては最も複雑で驚異的な反応である。この反応においては複数の立体化学が同時に制御される必要があり、鎖状の基質と酵素タンパクとの厳密な相互作用が重要であると考えられる。高等植物にはステロールの他に様々な異なる骨格を持つ環状トリテルペンが存在し、生成物の骨格に特異的な異なる閉環酵素により、それぞれの骨格が正確に作り分けられていると考えられ、骨格形成の特異性が酵素タンパク構造のどのような違いに起因するのか非常に興味が持たれる。動物、酵母におけるラノステロール合成酵素については、これまでに酵素の精製、遺伝子クローニングがなされ、酵素タンパクについての構造情報が得られつつある。一方、植物起源の閉環酵素については、ステロール生合成系のサイクロアルテノール合成酵素cDNAのクローニングが数種の植物から報告されているが、トリテルペン合成酵素に関しては、オレアナン骨格を形成する -アミリン合成酵素の精製が2種の植物からなされているのみであり、他の骨格のトリテルペン合成酵素についての情報は全く見られない。そこで、ダンマラン型とオレアナン型の2種類のトリテルペン骨格を持つジンセノサイドサポニンを主成分として生産するオタネニンジン(Panax ginseng)毛状根を材料に、酵素タンパクの精製、cDNAクローニングを試みた。 -アミリン合成酵素の精製が2種の植物からなされているのみであり、他の骨格のトリテルペン合成酵素についての情報は全く見られない。そこで、ダンマラン型とオレアナン型の2種類のトリテルペン骨格を持つジンセノサイドサポニンを主成分として生産するオタネニンジン(Panax ginseng)毛状根を材料に、酵素タンパクの精製、cDNAクローニングを試みた。 1.P.ginseng毛状根におけるオキシドスクアレン閉環酵素活性 ダンマレンジオールは、オキシドスクアレンがpre-chair-chair-chairのコンフォメーションをとり、エポキシドの開環により反応が開始され、段階的に環化反応が起きダンマレニル陽イオンが生成し、その後転移反応が起こることなく20位の陽イオンに水が付加し生成すると考えられている。これまでにダンマレンジオール合成酵素の酵素活性の検出は報告されておらず、まずP.ginseng毛状根におけるオキシドスクアレン閉環酵素活性について検討した。培養3週間目の毛状根より粗酵素液を調製し、[3-3H]-(RS)-2,3-オキシドスクアレンを基質としてTritonX-100を含む0.1Mリン酸緩衝液(pH7.4)中、30℃、1時間反応を行い、生成物をシクロヘキサンで抽出後TLCで分離し、逆相HPLCにより対応する生成物の位置を分取してその放射活性を測定した。その結果ミクロソーム画分に3種類(サイクロアルテノール、 -アミリン、ダンマレンジオール)の閉環酵素活性を検出した。生成したダンマレンジオールの20位の水酸基の配位については、逆相HPLCにおいて両ジアステレオマーが分離する条件(TOSOH ODS-80TM,90%aq.CH3CN)で各ピークに対応する位置を分取し放射活性を測定したところ、(20S)のフラクションにのみ活性が検出された。このことから、P.ginsengにおけるダンマレンジオール合成酵素は、真正サポニンと同じ20位の立体配置を有する(20S)-ダンマレンジオールのみを与えることが判明した。また、ダンマレンジオール合成酵素の諸性質を検討したところ、反応液中に界面活性剤の添加を必要とせず、また酸性側(pH6付近)で最も高い活性を示すなどこれまで報告されているオキシドスクアレン閉環酵素とは著しく異なる性質を示し、これが反応機構の違いを反映しているのか興味が持たれる。次に、各酵素の界面活性剤による可溶化を試みたが、いずれの閉環酵素も著しい活性の低下をもたらし、酵素の可溶化精製は断念せざるを得なかった。 -アミリン、ダンマレンジオール)の閉環酵素活性を検出した。生成したダンマレンジオールの20位の水酸基の配位については、逆相HPLCにおいて両ジアステレオマーが分離する条件(TOSOH ODS-80TM,90%aq.CH3CN)で各ピークに対応する位置を分取し放射活性を測定したところ、(20S)のフラクションにのみ活性が検出された。このことから、P.ginsengにおけるダンマレンジオール合成酵素は、真正サポニンと同じ20位の立体配置を有する(20S)-ダンマレンジオールのみを与えることが判明した。また、ダンマレンジオール合成酵素の諸性質を検討したところ、反応液中に界面活性剤の添加を必要とせず、また酸性側(pH6付近)で最も高い活性を示すなどこれまで報告されているオキシドスクアレン閉環酵素とは著しく異なる性質を示し、これが反応機構の違いを反映しているのか興味が持たれる。次に、各酵素の界面活性剤による可溶化を試みたが、いずれの閉環酵素も著しい活性の低下をもたらし、酵素の可溶化精製は断念せざるを得なかった。  Fig.12.P.ginseng毛状根からのオキシドスクアレン閉環酵素のcDNAクローニング Fig.12.P.ginseng毛状根からのオキシドスクアレン閉環酵素のcDNAクローニング 現在までにクローニングされているオキシドスクアレン閉環酵素は、いずれもステロールの骨格形成に関与する動物と酵母のラノステロール合成酵素と、植物のサイクロアルテノール合成酵素のみであり、トリテルペン合成酵素についてはクローニングの手がかりが全くない。そこで、「トリテルペン合成酵素はステロール合成酵素から分化してきたものであり、ステロール合成酵素とある程度相同性を持っている。」という仮定のもとに、現在までに知られているオキシドスクアレン閉環酵素間で生物種を越えて比較的よく保存されたアミノ酸配列がトリテルペン合成酵素にも存在することを期待し、相同性を利用したPCRにより本毛状根よりトリテルペン合成酵素のcDNAクローニングを行うことにした。ラノステロール及びサイクロアルテノール合成酵素間で比較的よく保存されている領域4ヶ所を選び縮重入り合成オリゴヌクレオチドプライマー(161S,463S,603A,711A)をデザインした。培養3週間目の毛状根よりRNAを抽出し、オリゴdTプライマーを用いて逆転写し、cDNAを調製した。これを鋳型として161Sと711Aで1回目のPCRを行い、463Sと603Aで2回目のPCRを行ったところ、450bpの生成物が得られた。この断片を大腸菌にサブクローニングし15クローンの配列を決定したところ、得られたクローンは3つにグループ分けすることができ、お互いに60%程度の相同性を示した。これらをPNX(9クローン)、PNY(3クローン)、PNZ(3クローン)と命名した(Fig.2)。一番多く得られたPNXは他種植物のサイクロアルテノール合成酵素と80%の相同性を示し、毛状根においてサイクロアルテノール合成酵素の活性が最も高かったことと併せてP.ginsengのサイクロアルテノール合成酵素のcDNAの一部であると考えられた。他の2種のクローンはこれらサイクロアルテノール合成酵素と60%の相同性を示し、トリテルペン合成酵素のcDNAである可能性が示唆された。  Fig.2 Fig.2 ついで、これら3種類の全長の配列を得るべく各クローンに特異的なプライマーを用いた3’-及び5’-RACEを行い、各々翻訳開始部位及び終止部位を含む全長約2.3kbの配列を得た。次にこれら3種類の全長クローンを酵母の系で発現させることにより機能の同定を試みた。各々PCRにより全長に相当する断片を得た後、酵母の発現ベクターであるpYES2のGAL1プロモーター下流に導入し、これらのプラスミドを用いてラノステロール合成酵素変異酵母株GIL77を形質転換した。ガラクトースによる発現誘導を行い、収穫後菌体を破砕して粗酵素液を調製し、in vitroの酵素活性の検出を行った。PNXのクローンを導入した酵母では顕著なサイクロアルテノール合成酵素活性が検出され、PNXのクローンがP.ginsengのサイクロアルテノール合成酵素をコードしていることが明らかとなったが、他の2種のクローンではいずれも期待するin vitroの酵素活性が検出されなかった。そこで、これら形質転換酵母においてオキシドスクアレンの閉環産物が蓄積しているのではないかと期待し、形質転換酵母における生成物を精査した。ガラクトースによる誘導を行った後にリン酸緩衝液中で24時間培養を行い、菌体をアルカリ(20%KOH/50%EtOH)加熱後、ヘキサンで抽出した。その結果、PNYのクローンを導入した酵母において -アミリンの生産が確認(HPLC、NMR)され、このクローンがP.ginsengの -アミリンの生産が確認(HPLC、NMR)され、このクローンがP.ginsengの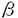 -アミリン合成酵素をコードしていることが明らかとなった。一方、PNZのクローンはこの条件においても、閉環産物の生産を確認することができず、ダンマレンジオール合成酵素をコードしていると推測されるものの未だ機能の同定には至っていない。 -アミリン合成酵素をコードしていることが明らかとなった。一方、PNZのクローンはこの条件においても、閉環産物の生産を確認することができず、ダンマレンジオール合成酵素をコードしていると推測されるものの未だ機能の同定には至っていない。 3.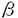 -アミリン合成酵素とルペオール合成酵素のキメラ酵素の作製およびその解析 -アミリン合成酵素とルペオール合成酵素のキメラ酵素の作製およびその解析 最近になってデータベース上、シロイヌナズナ由来のトリテルペン合成酵素であるルペオール合成酵素cDNAの塩基配列が報告された。このアミノ酸配列とP.ginsengの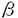 -アミリン合成酵素の配列を比較すると全領域に渡って70%の相同性を示した。ルペオールの骨格生成反応は -アミリン合成酵素の配列を比較すると全領域に渡って70%の相同性を示した。ルペオールの骨格生成反応は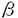 -アミリンの生成反応と途中まで全く同じメカニズムで進行するため、cDNAの配列上30%の違いが両化合物を作り分けていると考えられる(Fig.3)。これら生成物の作り分けが配列上どの領域に由来するのかを検討する目的で、両者のキメラタンパク質を上記の酵母の系で発現させ、その反応生成物を検討することにした。ルペオール合成酵素の全長クローンは報告された配列を基にプライマーをデザインし、シロイヌナズナより抽出したmRNAを逆転写して得たcDNAを鋳型としてPCRにより調製した。 -アミリンの生成反応と途中まで全く同じメカニズムで進行するため、cDNAの配列上30%の違いが両化合物を作り分けていると考えられる(Fig.3)。これら生成物の作り分けが配列上どの領域に由来するのかを検討する目的で、両者のキメラタンパク質を上記の酵母の系で発現させ、その反応生成物を検討することにした。ルペオール合成酵素の全長クローンは報告された配列を基にプライマーをデザインし、シロイヌナズナより抽出したmRNAを逆転写して得たcDNAを鋳型としてPCRにより調製した。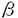 -アミリンとルペオール合成酵素の両者において全長をほぼ均等に2分する共通の制限酵素部位が存在したので、これを用いてキメラ体を構築し、先程と同様に形質転換酵母でのトリテルペンの生産を調べた。その結果、N末側半分を -アミリンとルペオール合成酵素の両者において全長をほぼ均等に2分する共通の制限酵素部位が存在したので、これを用いてキメラ体を構築し、先程と同様に形質転換酵母でのトリテルペンの生産を調べた。その結果、N末側半分を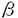 -アミリン、C末側半分をルペオール合成酵素の配列にしたキメラ体で -アミリン、C末側半分をルペオール合成酵素の配列にしたキメラ体で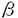 -アミリンとルペオールが約3:1の比率で生成していることが分かった。さらに全長を4分割する制限酵素部位を用いて14種類のキメラ体を作製し、機能を調べたところ、N末より260番目から340番目のアミノ酸残基の領域が両化合物の作り分けに重要な領域であることが明らかとなった。 -アミリンとルペオールが約3:1の比率で生成していることが分かった。さらに全長を4分割する制限酵素部位を用いて14種類のキメラ体を作製し、機能を調べたところ、N末より260番目から340番目のアミノ酸残基の領域が両化合物の作り分けに重要な領域であることが明らかとなった。  Fig.3 Mechanism Leading to Lupeol and Fig.3 Mechanism Leading to Lupeol and 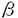 -Amyrin -Amyrin Fig.44.まとめ Fig.44.まとめ P.ginsengから3種のオキシドスクアレン閉環酵素cDNAを得、酵母の系による発現からそのうちの2種がサイクロアルテノール合成酵素と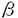 -アミリン合成酵素をコードするものと同定した。これらのアミノ酸配列は60%の相同性を示し、これまで全く不明であったトリテルペン合成酵素は、サイクロアルテノール合成酵素と進化的にも近い関係にあることが明らかとなった。このことは、他のトリテルペン合成酵素のクローニングに道を開いたことを意味し、植物に存在する多種多様な骨格を持つ環状トリテルペンの生成機構の解明に向けて大きく展望を開いたと考えている。今後、有機化学と分子生物学の手法を融合し、ダンマランからオレアナンを経てフリーデラン骨格に至るまでのメチル基とヒドリドの転位機構、反応の終止におけるプロトンの引き抜き機構、等を明らかにしていきたいと考えている。 -アミリン合成酵素をコードするものと同定した。これらのアミノ酸配列は60%の相同性を示し、これまで全く不明であったトリテルペン合成酵素は、サイクロアルテノール合成酵素と進化的にも近い関係にあることが明らかとなった。このことは、他のトリテルペン合成酵素のクローニングに道を開いたことを意味し、植物に存在する多種多様な骨格を持つ環状トリテルペンの生成機構の解明に向けて大きく展望を開いたと考えている。今後、有機化学と分子生物学の手法を融合し、ダンマランからオレアナンを経てフリーデラン骨格に至るまでのメチル基とヒドリドの転位機構、反応の終止におけるプロトンの引き抜き機構、等を明らかにしていきたいと考えている。 |