【 Gbindの定式化】
Gbindの定式化】 リガンド・受容体の結合の過程をFig.1のように分解して考える。まず分子が接触面で脱溶媒和( GdesolvES)を受ける。続く会合の過程でリガンド重心の並進と回転の自由度及び分子内自由度が消失(
GdesolvES)を受ける。続く会合の過程でリガンド重心の並進と回転の自由度及び分子内自由度が消失( Gtr-rot,
Gtr-rot, Gconf)し、その一方で分子間立体反発(
Gconf)し、その一方で分子間立体反発( Grep)・疎水性相互作用(
Grep)・疎水性相互作用( GHphob)・分子間静電相互作用(
GHphob)・分子間静電相互作用( GinterES)が形成される。そこで
GinterES)が形成される。そこで Gbindを(2)式のように、各自由エネルギー項にcdE,ctr,ccf,etc.の係数をかけた和で表現することにした。
Gbindを(2)式のように、各自由エネルギー項にcdE,ctr,ccf,etc.の係数をかけた和で表現することにした。

式中の各エネルギー項の中身についても独自の定式化を行った。
(1)脱溶媒和エネルギー静電項 GdesolvES
GdesolvES 分子表面の一部での脱溶媒和エネルギー静電項 GdesolvESを直接測定する方法はなく、また計算に用いる理論式も一般的で簡便な形のものは確立していない。そこで本研究では部分表面についての
GdesolvESを直接測定する方法はなく、また計算に用いる理論式も一般的で簡便な形のものは確立していない。そこで本研究では部分表面についての GdesolvESに対し独自の定式化を行い、実測可能な分子全体の溶媒和自由エネルギー
GdesolvESに対し独自の定式化を行い、実測可能な分子全体の溶媒和自由エネルギー Gsolvのデータを利用して式中のパラメターを決定することにした。
Gsolvのデータを利用して式中のパラメターを決定することにした。
 GdesolvESは、溶質分子表面の誘起表面電荷が分子同士の接触によって取り除かれる時のエネルギーと考える。これを計算するためまず分子表面を微小表面要素
GdesolvESは、溶質分子表面の誘起表面電荷が分子同士の接触によって取り除かれる時のエネルギーと考える。これを計算するためまず分子表面を微小表面要素 Sに分割し、要素i上での複合体形成により取り除かれる誘起表面電荷密度
Sに分割し、要素i上での複合体形成により取り除かれる誘起表面電荷密度 を今回独自に考案した(3)式で計算する。
を今回独自に考案した(3)式で計算する。
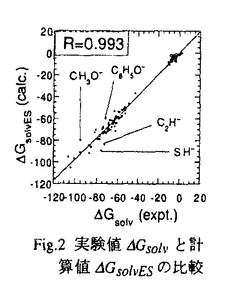 Fig.2 実験値
Fig.2 実験値 Gsolvと計算値
Gsolvと計算値 GsolvESの比較
GsolvESの比較 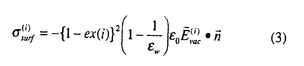
ここでex(i)は要素iが属する原子の複合体形成時の露出率で、疎水コアに近いパッキングをうけている時は0、溶媒に露出している時は1に近い値をとる。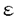 0,
0,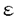 wは各々真空中・溶媒中での誘電率、
wは各々真空中・溶媒中での誘電率、 は溶質分子の原子電荷由来の電場、
は溶質分子の原子電荷由来の電場、 は表面要素に垂直な単位ベクトルである。
は表面要素に垂直な単位ベクトルである。
 GdesolvESはこの誘起表面電荷と溶質分子の原子電荷の相互作用から(4)式により計算する。
GdesolvESはこの誘起表面電荷と溶質分子の原子電荷の相互作用から(4)式により計算する。

(3)式で分子全体について を計算し(4)式の符号を逆転させれば、溶質分子全体の溶媒和自由エネルギー静電項
を計算し(4)式の符号を逆転させれば、溶質分子全体の溶媒和自由エネルギー静電項 GsolvESを計算できる。溶媒和自由エネルギー
GsolvESを計算できる。溶媒和自由エネルギー Gsolvのうち最も大きな寄与はこの静電項
Gsolvのうち最も大きな寄与はこの静電項 GsolvESであると考えられるので、
GsolvESであると考えられるので、 Gsolv≒
Gsolv≒ GsolvESとしてよいであろう。この計算法は3個のパラメターを必要とするが、これらは計算値
GsolvESとしてよいであろう。この計算法は3個のパラメターを必要とするが、これらは計算値 GsolvESが実験値
GsolvESが実験値 Gsolvを再現するように決定した。Fig.2にパラメター決定に用いた120個の低分子化合物について実験値
Gsolvを再現するように決定した。Fig.2にパラメター決定に用いた120個の低分子化合物について実験値 Gsolvと計算値
Gsolvと計算値 GsolvESを比較した結果を示す。
GsolvESを比較した結果を示す。
受容体側の GdesolvESは最終的な結果に影響しないことが確かめられたので、この項はリガンド側についてのみ計算する。
GdesolvESは最終的な結果に影響しないことが確かめられたので、この項はリガンド側についてのみ計算する。
(2)リガンドの並進・回転自由度消失 Gtr-rot
Gtr-rot リガンド重心周りの自由度消失の効果はリガンドによらないので定数とした。

(3)リガンド分子内の自由度消失 Gconf
Gconf リガンド分子内のsp3型bond数に比例すると考える。メチル基などの末端のbondや露出率が大きいbond、環に含まれるbondは自由度消失の効果が小さいので数えない。
ただし7員環以上の環についてはflexibilityを考慮に入れた。

(4)リガンド・受容体間の立体反発 Grep
Grep vdW potential(AMBER力場を使用)のうち12乗反発項を用いるが、induced fitを考慮に入れるため受容体側の原子の露出率でスケーリングする。
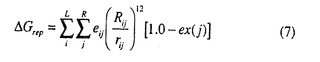
(5)疎水性相互作用 GHphob
GHphob これまでの方法では分子間接触表面積に単純に比例する形の定式化が一般的であった。しかし本研究では分子間接触表面積のうち相手分子のvdW表面と密着している部分をhydrophobic contact surfaceと定義して、これに比例する形での定式化を行った。

(6)分子間静電相互作用 GinterES
GinterES 形式上は古典的なクーロン相互作用を用いる。誘電率については実験的に求められた実効誘電率関数を参考にしつつ、露出率に応じて変化する関数形を独自に考案した。
