近年、蛋白質の単離精製や遺伝子的生産の技術の進歩とともに立体構造の解明が急速に進み、標的蛋白質の構造に基づいて論理的に医薬分子設計を行うStructure-Based Drug Design(SBDD)の可能性が増してきた。コンピュータを用いた手法の進歩もめざましく、リード創製をはじめとしてさまざまな目的が達成されるようになってきた。SBDDは創薬過程の効率化のみならず、偶然や試行錯誤に頼るこれまでの手法ではできない創薬を可能にすることが期待される。特に異生物種やサブタイプ間のアミノ酸配列のわずかな違いにもとづく、標的蛋白に特異的なリガンドの設計に期待がもたれる。 また近年、熱帯熱マラリア原虫Plasmodium falciparum(以下P.f.と略す)の特効薬であるpyrimethamineやcycloguanilに対する耐性株が蔓延し、有効な治療薬がないために死に至らしめることが問題になっている。この耐性は、ジヒドロ葉酸還元酵素(DHFR)-チミジル酸合成酵素(TS)のDHFRドメインのアミノ酸変異に起因し、特にSer108のAsnやThrへの変異がキーであることが知られている(表1)。しかし、これまでに試みられたDHFR阻害剤のランダムアッセイ的な探索では、S108Nの変異で阻害能が落ちないものはみつかっていない。DHFRについては既に数多くの生物種で結晶構造が解析され、活性部位に共通する構造や必須なアミノ酸が特定されているため、結晶解析されていない種のDHFRでも構造の推定が可能になっている。そこで、当研究者は上記耐性株にも有効な阻害剤を目指してSBDDによる設計を行った。  表1 P.falciparum DHFR domainの50%阻害濃度 表1 P.falciparum DHFR domainの50%阻害濃度 また本研究では、実際に薬剤開発を行う以外に、選択的リガンドを設計するための分析手法とその理論的背景の研究も行った。その内容は第5章に記してある。この分析手法は第3章で具体的に使用している。 また本研究活動において、蛋白質立体構造に基づいて分子設計を行った経験から、水分子の構造化を理解することの重要性を実感した。そこで、蛋白質結晶構造中の水分子が形成する水素結合を統計的に調べ、この結果に基づき水分子の水素結合パターンの観察される頻度を表す相関式を得た。これに基づき蛋白質構造上で構造化する水分子の位置を予測する方法を開発した。これに関しては一つの独立した研究となっており、第6章にすべてまとめてある。 P.f.DHFR domainと構造既知DHFRとのアラインメントおよびモデル構造の作成 まず、human,chicken liver,E.coli,L.casei DHFR結晶構造の重ね合わせによって得た配列のアラインメントに対して、P.f.DHFR domainの配列をプロファイルアラインメントした結果を図1に示す。P.f.とこれらDHFRとの相同性は24-33%と高くないが、活性部位で重要なアミノ酸はP.f.DHFR domainでもすべて保存されていた。このアラインメントに基づいて構築したモデル構造の活性部位に基質や既知阻害剤が矛盾なくドッキングでき、またこのモデル構造に安定にドッキングできるという観点で市販化合物リストより選抜した化合物から新規の阻害化合物が見つかったことから(表2)、図1のアラインメントおよびモデル構造が妥当であることを確認できた。  図1 P.falciparumおよび構造既知DHFRのアミノ酸配列アラインメント 図1 P.falciparumおよび構造既知DHFRのアミノ酸配列アラインメント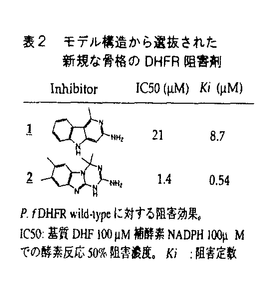 表2 モデル構造から選抜された新規な骨格のDHFR阻害剤大腸菌DHER T46N-Methotrexate複合体のX線結晶構造解析 表2 モデル構造から選抜された新規な骨格のDHFR阻害剤大腸菌DHER T46N-Methotrexate複合体のX線結晶構造解析 問題のP.f.S108はE.coliではT46に対応し(図1太字)、周囲6Å以内のアミノ酸の一致が高いため、46位アミノ酸を変異させたE.coli DHFRはP.f.の構造の代用になる。構造既知DHFR中でP.f.S108に対応する残基はすべてThrであり、耐性化変異により生じるAsn108周辺構造の知見はない。新たな官能基をもつこの側鎖の配向と周囲環境の構造を解明することにより、耐性株に有効な阻害剤設計の手掛かりにしたいと考え、E.coli DHFR T46N酵素の提供をうけて、X線結晶構造解析(分解能1.75Å)を行った。E.coli DHFR N46側鎖のアミノ基は主鎖の2つのカルボニル酸素と水素結合することで位置が固定されているのに対し、カルボニル酸素は阻害剤Methotrexateの方向を向いている(図2)。この新たなカルボニル基との相互作用で結合性を増すリガンドを設計することにした。  図2 E.coli DHFR T46N mutant結晶構造における活性部位周辺のアミノ酸Asn型DHFRに特異的な阻害剤 図2 E.coli DHFR T46N mutant結晶構造における活性部位周辺のアミノ酸Asn型DHFRに特異的な阻害剤 E.coli N46側鎖と水素結合する化合物をみつける方法としては、入手可能試薬データベースを以下の方法を用いて検索した。Methotrexateの部分構造である2,4-diamino-pyrimidine(図3)を含む化合物を抽出し、蛋白構造に順次はめ込み、配座を変えながら複合体の安定性を計算して173化合物の候補に絞りこんだ。次に、図3のGroup A,B,Cとの水素結合可能性を判定した。最終的に絞りこんだ12化合物を購入し、阻害活性を測定した。  図3 E.coli DHFR N46結晶構造に基づく阻害剤候補化合物のデータベース検索 図3 E.coli DHFR N46結晶構造に基づく阻害剤候補化合物のデータベース検索 それら化合物のうち2,8-diamino-6-mercaptopurine(DAMP)は100 MでE.coli N46酵素を63%阻害し、E.coli S46酵素の活性を全く阻害しなかった。P.f.DHFR domainを使った阻害実験でもwild-type(S108)よりもN108をもつ方を強く阻害した(図4)。また、毒性となるhuman DHFRへの阻害は全くなかった(図4)。これはhumanDHFRではこの部位がThrであるためと考えられる。また、速度論的解析から、DAMPのP.f.R59-N108に対する阻害は基質のジヒドロ葉酸と拮抗的で、阻害定数は5.6 MでE.coli N46酵素を63%阻害し、E.coli S46酵素の活性を全く阻害しなかった。P.f.DHFR domainを使った阻害実験でもwild-type(S108)よりもN108をもつ方を強く阻害した(図4)。また、毒性となるhuman DHFRへの阻害は全くなかった(図4)。これはhumanDHFRではこの部位がThrであるためと考えられる。また、速度論的解析から、DAMPのP.f.R59-N108に対する阻害は基質のジヒドロ葉酸と拮抗的で、阻害定数は5.6 Mであった。以上より、DAMPはP.f.DHFR N108変異株群に対する特異的阻害剤リードとして有望である。DAMPのE.coli DHFR N46活性部位への推定結合様式を図5に示す。 Mであった。以上より、DAMPはP.f.DHFR N108変異株群に対する特異的阻害剤リードとして有望である。DAMPのE.coli DHFR N46活性部位への推定結合様式を図5に示す。  図4 P.f.,human DHFRに対するDAMPの阻害効果 図4 P.f.,human DHFRに対するDAMPの阻害効果 図5 E.coli DHFR N46活性部位におけるDAMPの推定結合様式Thr型DHFRに特異的な阻害剤 図5 E.coli DHFR N46活性部位におけるDAMPの推定結合様式Thr型DHFRに特異的な阻害剤 E.coli変異DHFRの結晶解析の結果(図2)から、N46側鎖もS46側鎖も親水的な環境を作り出していた。その反対にT46側鎖メチルは阻害剤の方を向いており、疎水的な環境を作りだしていた。図2でこの変異部位にpteridine環の6位置換基が接近していることから、ここが疎水的な表3の阻害剤はThr型DHFR選択的になると考えた。6位が疎水的な阻害剤3はE.coli S46やN46よりもT46の酵素を強く阻害した。3はP.f.でもwildtype(S108)よりA16V-S10O8Tを同様に強く阻害した(表3)。さらに疎水性を増した6は阻害能が48nMまで向上した。  表3 疎水的6位置換基をもつ阻害剤のDHFR活性および原虫増殖の50%阻害濃度ヒトDHFRに対する選択性の向上 表3 疎水的6位置換基をもつ阻害剤のDHFR活性および原虫増殖の50%阻害濃度ヒトDHFRに対する選択性の向上 Human DHFRの阻害は毒性となるが、表3左1列目のhuman DHFR 50%阻害濃度とP.f.を比較すると、酵素レベルでの選択性は二桁以上あった。これは7位置換基周辺の蛋白構造がP.f.ではAsp54-Met55であるのに対し(図6a)、humanではGlu30-Phe31と大きいため(図6b)、ここでの立体効果がhumanの方により不利に働くことで選択性が増していると考えられる。  図6 P.f.-human DHFR間の阻害剤結合部位の違い蛋白質の違いによるリガンド分子の識別 図6 P.f.-human DHFR間の阻害剤結合部位の違い蛋白質の違いによるリガンド分子の識別 阻害定数による選択性 (蛋白Q,R間でのaの選択性)と (蛋白Q,R間でのaの選択性)と (蛋白Q,R間でのbの選択性)の比 (蛋白Q,R間でのbの選択性)の比 は蛋白Q,R間でリガンドa,bを交換する平衡反応の平衡定数である。 は蛋白Q,R間でリガンドa,bを交換する平衡反応の平衡定数である。  「識別」という概念を次のように定義した。 定義:上式の平衡がどちらか一方に傾くならば、蛋白質Q,R間の違いでもってリガンドa,b間の違いが識別できている。また、平衡が傾かないならば、蛋白質Q,R間の違いでもってリガンドa,b間の違いが識別できていない。その識別度を定量的に表すのが である。 である。 この量を指標にしてリガンドを分子設計するのが最も容易である。なぜなら「識別」はすべて蛋白質-リガンド複合体状態のみから成り立っており、複合体状態の構造をもとに行う分子設計ですべての状態をカバーできるからである。第3章ではhuman DHFR,P.falciparum DHFRの違いで阻害剤の形状性を識別し、分類を試みている。 蛋白結晶構造にみられる水分子構造の統計的解析 蛋白質表面における水分子の構造化は蛋白の安定化や水分子を介したリガンドの認識に重要である。ここでは39個の高分解能蛋白質結晶構造中の水分子でその周囲の構造が完全に解析されているものについて水素結合の傾向性を統計的に調べた。その結果82%の水分子がその周囲の蛋白質原子や水分子と3本以上の水素結合を形成していた。ところが、蛋白質原子とだけで3本以上水素結合できているものは少なく、72%の水が蛋白質原子と2本以下の水素結合を形成していた。このことから水分子どうしが互いに水素結合しあうことで互いに3本以上の水素結合を保っていることが示唆される。よって、蛋白質上で構造化する水分子の位置を予測するには、蛋白質原子と水分子の間の水素結合のみならず、水分子-水分子間の水素結合も考慮することが重要である。また、水分子が形成する水素結合間角の頻度分布は109,5度に典型的なピークがあったことから、正四面体構造の水素結合をとりやすいことが示された。構造化した水分子の水素結合に特徴的な上記の傾向性を水素結合パターンとそれが観察される頻度の対数との相関式で表現した。そして上記の傾向性の重要性を理解するために、導いた相関式に基づいて16個の高分解能蛋白質表面の水分子の位置を予測してみた。ここで用いた仮説は水の構造化は水分子自身が好む水素結合様式の傾向性のみから再現できるということである。その結果、結晶構造にみられるB-factorが40Å2以下の水分子の82%についてその位置を正しく予測することができ、水素結合ネットワークも再現することができた。ここではこの相関式を疑似エネルギーとよぶ。これによれば水素結合が2本以下の水分子は不安定となることから、疎水効果が自然と反映されている。以上の結果は水分子の構造化に関して新しい視点を我々に与えてくれる。 |