| 内容要旨 | | 【序】 好中球はFMLPなどの走化性物質の刺激により,1)活性酸素の産生,2)細胞内顆粒からの酵素群の放出、3)刺激に対する遊走,などの応答を引き起こす。これらの応答へ至る細胞内情報伝達の研究のうち,遊走に関わる研究は比較的少ない。その理由は,アゴニストとして汎用される走化性ペプチドFMLPが上記の3つの応答をすべて惹起してしまうことと,細胞の遊走または形状変化をリアルタイムでかつ定量的に追跡する手段がないためと思われる。 ハチ毒から抽出された走化性ペプチド,Icaria chemotactic peptide(I-CP)は,FMLPと同様1)〜3)の応答を惹起するが,そのアミノ酸配列7番目のProをLysに置換したアナログ[Lys7]I-CPは遊走しか起こさない。そこで私は本研究でまず遊走と細胞内Ca2+([Ca2+]i)との関係を調べるため,共焦点レーザー顕微鏡を用いてFMLP,I-CP,[Lys7]I-CPの3つのペプチド(Fig-1)の好中球に対する[Ca2+]iの上昇応答について比較検討した1)。一方,好中球が走化性ペプチドなどの刺激を受けて遊走する際,細胞骨格蛋白質アクチンが盛んに重合・脱重合することが知られているが,遊走と[Ca2+]の変化の関係は未だ不明な点が多い。そこで私は,遊走応答におけるアクチンと[Ca2+]iの関係を調べるため,蛍光標識したアクチンを蛍光性Ca2+キレート剤Fluo3とともに好中球にインジェクションし、好中球の形状変化及びアクチン分布変化と[Ca2+]iの変化の同時追跡を試みた。  Fig-1 実験に用いた走化性ペプチド【実験方法】<共焦点レーザー顕微鏡を用いた[Ca2+]iの測定> Fig-1 実験に用いた走化性ペプチド【実験方法】<共焦点レーザー顕微鏡を用いた[Ca2+]iの測定> 好中球はすべて1%glycogen/salineで刺激したモルモット腹腔より採取したものを用いた。Fluo3はアセトキシメチル体の形で好中球に取り込ませた。いくつかの実験では,好中球を予め百日咳毒素にて処理した後Fluo3を取り込ませた。37℃でフレインキュベートした後,温度を保ったままペプチドを添加し,共焦点レーザー顕微鏡Leica CLSMにて,[Ca2+]の変化をFluo3の蛍光強度変化として,25秒ごとに450-500秒まで測定した。得られた画像について,個々の細胞全体の蛍光の総量を経時的に解析した。 <蛍光標識actinの調製> ウサギ骨格筋アクチン(F-form)を,蛍光性SH基標識試薬iodoacetamido morpholino rhodamine(IMR)と室温・遮光で1時間インキュベートし、超遠心して得たペレットを透析によりG-formへと脱重合させ、Sephadex G-25カラムで精製した。このIMR-標識アクチン(IMR-アクチン)は,in vitroにてイオン強度を変化させて重合・脱重合させ,標識によって重合活性が阻害されていないことを確認した。 <共焦点レーザー顕微鏡によるIMR-アクチンと[Ca2+]iの同時測定> IMR-アクチンをFluo3と混合し、先端の直径が0.5 mのガラス針に導入し、EppendorfのMicrotransjectorを用いて,直径10 mのガラス針に導入し、EppendorfのMicrotransjectorを用いて,直径10 mのモルモット好中球内にマイクロインジェクションした。ペプチドは比重を高めるために5%glycerol/Hanks液にて希釈し,濃度勾配が生じるように一定方向から細胞に加えた。蛍光の経時変化の測定には共焦点レーザー顕微鏡Meridian ACAS Ultima Zを用い、フィルターにはdichroic 560SP・530BP・605LPを使って、Fluo3の緑色蛍光とIMR-アクチンの赤色蛍光とを30秒ごとに600-1200秒まで同時測定した。 mのモルモット好中球内にマイクロインジェクションした。ペプチドは比重を高めるために5%glycerol/Hanks液にて希釈し,濃度勾配が生じるように一定方向から細胞に加えた。蛍光の経時変化の測定には共焦点レーザー顕微鏡Meridian ACAS Ultima Zを用い、フィルターにはdichroic 560SP・530BP・605LPを使って、Fluo3の緑色蛍光とIMR-アクチンの赤色蛍光とを30秒ごとに600-1200秒まで同時測定した。 <IMR-アクチンと[Ca2+]iの同時測定結果の画像解析> 30秒ごとに得られた赤・緑蛍光の重ね合わせの画像データを2色に分解し,緑と赤をそれぞれFluo3([Ca2+]i)およびIMR(アクチン)のデータとし,それぞれについて細胞内分布及び経時的な濃度変化を解析した。 【結果・考察】1.FMLP,I-CP,[Lys7]I-CPによる好中球の細胞内Ca2+濃度の変化 FMLPとI-CPは好中球に対して活性酸素の産生,酵素の放出と遊走の反応を惹起するのに対して,[Lys7]I-CPは遊走しか引き起こさない。一方,これらのペプチドはすべて2相性の[Ca2+]i上昇を引き起こした。どのペプチドの場合も,初期の[Ca2+]i上昇は外界のCa2+に依存しないことから,細胞内プールからの放出と考えられる。また,後期の[Ca2+]i上昇は培地中のCa2+に依存するので,細胞外からの流入によると考えられる。また,濃度上昇のピークは,FMLPとI-CPとで約25-50秒と200-400秒であるのに対して,[Lys7]I-CPでは約75-150秒と300-500秒であり,ピーク時間がずれていた(Fig-2)。さらに好中球を百日咳毒素で処理すると,FMLPおよびI-CPでは初期ピークのみ抑制されたのに対して,[Lys7]I-CPではすべて消失していた。これらの結果から,遊走活性しか持たない走化性ペプチド[Lys7]I-CPでは,細胞内の[Ca2+]i上昇のシグナル伝達経路がFMLPやI-CPの場合とは異なることが示された。 2.FMLP刺激による好中球内のアクチン動態及び細胞内Ca2+動態 Fig-2 共焦点レーザー顕微鏡による好中球の細胞内Ca2+の変化(横軸はペプチド添加後の時間)1)好中球内アクチンと細胞内Ca2+の同時測定 Fig-2 共焦点レーザー顕微鏡による好中球の細胞内Ca2+の変化(横軸はペプチド添加後の時間)1)好中球内アクチンと細胞内Ca2+の同時測定 走化性ペプチドとしてFMLPを用い,刺激後の好中球内のアクチンと[Ca2+]iの動態を解析した。IMR-アクチンとFluo3をインジェクションしたあと,好中球を培養液中で37℃,20分間インキュベートした。その後,Hanks液中でFMLPで刺激したところ,インジェクションにより破裂するなどダメージを受ける細胞も多く見られたが,50-60%の細胞で,ペプチド刺激に対して[Ca2+]i上昇及びアクチンの分布変化や形状変化が認められた。測定後の細胞を固定し,F-actinに特異的に結合するFITC-phalloidinで染色したところ,FITC-phalloidinの蛍光像とIMRアクチンの蛍光像の重なりが観察されたことから,注入したIMRアクチン(G-form)の一部がF-actinとして実際に機能していることが示唆された。このように,ウサギ骨格筋由来のアクチンを蛍光標識してFluo3とともにマイクロインジェクションする方法で,好中球内のアクチン動態と[Ca2+]i動態を同時に経時的に測定することに初めて成功した。 2)好中球内のアクチンと細胞内Ca2+の動態 FMLP刺激後の好中球内におけるアクチンと[Ca2+]iの動態について,以下のように解析した。すなわち,細胞内を東西南北(FMLPは西から加える)に見立てた4カ所と中心部との計5カ所における蛍光強度の経時変化を解析して,それぞれの場所におけるアクチンとCa2+の濃度変化を追跡した。 FMLP刺激後に起こる初期の反応(およそ2分以内)においては,アクチンと[Ca2+]iも刺激方向とは無関係に細胞全体で一過性の急激な濃度上昇とそれに続く減少とが観察された(Fig-3)。また,各部分でのアクチン濃度とCa2+濃度の経時変化を見ると,その増減の時間的経過はほぼ一致していた(Fig-4)。 次にFMLP刺激後の後期の反応(およそ2-10分の間)では,アクチンとCa2+の一過性の緩やかな濃度上昇が観察され,その後濃度は減少し続けた(Fig-4)。この後期の反応においては,大部分の好中球が刺激方向に向かって徐々に移動した。その際,刺激方向によらずに細胞の各部でアクチンとCa2+の濃度変化が認められたが,多くの細胞では,刺激を受けた側においてより大きい濃度変化が観察された。一部の細胞では,刺激方向とは無関係に細胞の周辺部により大きいアクチンとCa2+の濃度変化が観察されたが,この場合もやはり,アクチンとCa2+の変化の時間的経過は一致していた。すなわち,好中球はFMLPによる刺激後,初期の反応では刺激方向とは無関係に細胞全体で[Ca2+]iとアクチンが同調して一過性の急激な濃度変化を示し,一方細胞が遊走を始める後期の反応では,刺激を受けた側または周辺部において[Ca2+]iとアクチンが同調して一過性の緩やかな濃度変化を示していた。  Fig-3 FMLP添加による[Ca2+]iとactinの動態変化(括弧内数字FMLP添加後の時間) Fig-3 FMLP添加による[Ca2+]iとactinの動態変化(括弧内数字FMLP添加後の時間)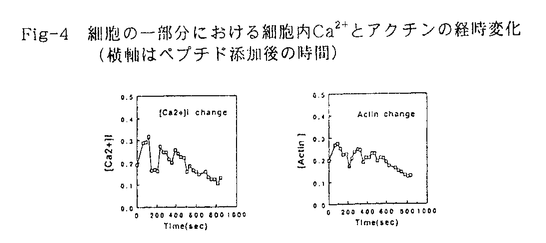 Fig-4 細胞の一部分における細胞内Ca2+とアクチンの経時変化(横軸はペプチド添加後の時間)参考文献1)Maruyama W.,Hagiwara K.,Fukushima T.,Santa T.,Homma H.and Imai K.Bioimages 5.1-9(1997) Fig-4 細胞の一部分における細胞内Ca2+とアクチンの経時変化(横軸はペプチド添加後の時間)参考文献1)Maruyama W.,Hagiwara K.,Fukushima T.,Santa T.,Homma H.and Imai K.Bioimages 5.1-9(1997) |