膜タンパク質は膜内で拡散運動をおこなうことにより膜平面上を移動して、会合や集合をおこなう。この過程は、信号伝達、高分子の取り込みと分泌、細胞間接着などの重要な膜機能の発現に直接関わっている。すなわち、細胞は、膜タンパク質の機能を制御するために、膜タンパク質の集合や局在を制御しているのであるが、その機構については、ほとんどわかっていない。 私は、膜タンパク質の運動や集合・局在化などの制御には、膜タンパク質と細胞骨格の相互作用が大きく関与していると考え(図1:膜骨格フェンスモデル)、膜骨格による膜タンパク質の運動制御の機構を、一分子観察・操作法(図2:一粒子追跡法、図3:光ピンセット法)を用いて、ナノメートル/ピコニュートンの精度と0.22ミリ秒の時間分解能で解析した。このモデルを検証するための実験系としては、赤血球膜を選んだ。赤血球膜骨格の構造は非常によく調べられており、スペクトリンテトラマーがネットワークを形成し、網目の結節点の位置に短いアクチンフィラメントとプロテイン4.1が存在して、スペクトリンの尾部をつなぎ止めていることが分かっている(図2)。 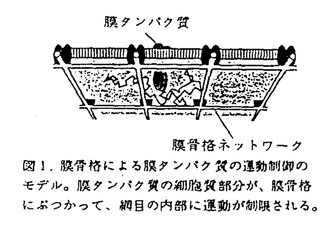 図1.膜骨格による膜タンパク質の運動制御のモデル。膜タンパク質の細胞質部分が、膜骨格にぶつかって、網目の内部に運動が制限される。 図1.膜骨格による膜タンパク質の運動制御のモデル。膜タンパク質の細胞質部分が、膜骨格にぶつかって、網目の内部に運動が制限される。 図2.膜タンパク質分子の運動を追跡する方法。金コロイド粒子を、抗体を介して膜タンパク質に結合させ、金コロイドの運動を可視化する。 図2.膜タンパク質分子の運動を追跡する方法。金コロイド粒子を、抗体を介して膜タンパク質に結合させ、金コロイドの運動を可視化する。 図3.光ピンセットによって金コロイドを捕捉し、膜タンパク質を細胞膜に沿って動かし、膜骨格の効果を調べる 図3.光ピンセットによって金コロイドを捕捉し、膜タンパク質を細胞膜に沿って動かし、膜骨格の効果を調べる (1)まず、バンド3分子の運動を一分子レベルで観察した(図2)ところ、バンド3の約30%はほとんど動かなかったのに対して、残りの70%はドメイン間をホップしながら移動していくという運動を示した(図4)。長時間(〜10分間)観察すると、時々両者の間の運動様式の変換がみられた。  図4.赤血球バンド3の運動の軌跡の典型例。約0.7秒間のバンド3の運動を示す。2ミリ秒ごとに位置を求め、それを直線でつないで表示してある。点線はドメインを示す。 図4.赤血球バンド3の運動の軌跡の典型例。約0.7秒間のバンド3の運動を示す。2ミリ秒ごとに位置を求め、それを直線でつないで表示してある。点線はドメインを示す。 前者のバンド3は、同じ場所で直径100nm程度の範囲内を振動しているだけであった。また、このバンド3は光ピンセットで引っ張るとすぐにはずれて元の位置に戻ることから、膜骨格に直接結合していると考えられる(スペクトリンを引っ張ったときも同じであった)。 後者のバンド3は、短時間は直径110nm程度のドメイン内部に制限され、その内部で速い拡散運動(拡散係数は5×10-9cm2/sで自由拡散と考えられる)をしていたが、平均して350msに一度隣のドメインに移り、それを繰り返しながら広い範囲を運動していた。このような運動の特徴は、膜骨格フェンスモデル(図1)と一致する。 (2)バンド3の細胞質部分の大きさが運動制限に与える影響を調べるために、赤血球膜を低濃度のトリプシンで処理して(アンキリンは切断されたが、スペクトリンとアクチンはインタクトのまま)、バンド3の細胞質部分を切断した。切断前後で、ドメイン内部での拡散速度とドメインの大きさは変化しなかったが、隣のドメインへ移動するホップの頻度が、切断後は6倍上昇した。この結果は、バンド3の細胞質部分の大きさがドメイン間のホップのしやすさを決める要因であることを示唆するものである。 (3)バンド3の細胞質部分が膜骨格にぶつかっていることをより直接的に確かめるために、光ピンセットで膜骨格をつかんで引っ張った(図5)。膜骨格を引っ張るために、表面にバンド3に対する抗体をたくさん吸着させた直径1 mのラテックスビーズを、赤血球膜に結合させた。30%程度のバンド3は膜骨格に直接結合しているので、このビーズはバンド3を介して膜骨格に結合している。このビーズを光ピンセットで捕捉し、引っ張ることによって、膜骨格のネットワークを大きく変形させると(1.8 mのラテックスビーズを、赤血球膜に結合させた。30%程度のバンド3は膜骨格に直接結合しているので、このビーズはバンド3を介して膜骨格に結合している。このビーズを光ピンセットで捕捉し、引っ張ることによって、膜骨格のネットワークを大きく変形させると(1.8 m/sの一定速度)、同じ赤血球膜上にある、膜骨格に直接結合していないバンド3は、膜骨格を引っ張っている間だけ、膜骨格と同じ方向へ移動した。引っ張るのを止めた後は、移動した先で拡散運動を続けた。 m/sの一定速度)、同じ赤血球膜上にある、膜骨格に直接結合していないバンド3は、膜骨格を引っ張っている間だけ、膜骨格と同じ方向へ移動した。引っ張るのを止めた後は、移動した先で拡散運動を続けた。  図5.膜骨格とバンド3との相互作用を調べる実験の模式図。膜骨格ネットワークを光ピンセットで引っ張って大規模に変形させ、そのときのバンド3の応答を見る。 図5.膜骨格とバンド3との相互作用を調べる実験の模式図。膜骨格ネットワークを光ピンセットで引っ張って大規模に変形させ、そのときのバンド3の応答を見る。 脂質の場合には、1.8 m/sの速度で膜骨格を引っ張っても、ほとんど運動に影響を受けなかった(18 m/sの速度で膜骨格を引っ張っても、ほとんど運動に影響を受けなかった(18 m/sの速度で引っ張るとわずかに変位した)。それに対して、バンド3は、0.15 m/sの速度で引っ張るとわずかに変位した)。それに対して、バンド3は、0.15 m/sの速度で引っ張った場合でも、同じ距離だけ移動した。これらの結果は、バンド3の変位は、膜内での疎水的な相互作用によるのではなく、バンド3の細胞質部分と膜骨格との間の相互作用(立体障害)によるものであることを示すものである。 m/sの速度で引っ張った場合でも、同じ距離だけ移動した。これらの結果は、バンド3の変位は、膜内での疎水的な相互作用によるのではなく、バンド3の細胞質部分と膜骨格との間の相互作用(立体障害)によるものであることを示すものである。 (4)バンド3分子を光ピンセットを用いて赤血球膜上を様々な速度で引っ張った(図3)。1.6 m/s以下の速度でバンド3を引っ張った場合には、自由に膜上を動かすことができたが、1.6 m/s以下の速度でバンド3を引っ張った場合には、自由に膜上を動かすことができたが、1.6 m/s以上の速度で引っ張ると途中で引っかかって光ピンセットからはずれるようになった。これは、1.6 m/s以上の速度で引っ張ると途中で引っかかって光ピンセットからはずれるようになった。これは、1.6 m/s以下の速度でバンド3を引っ張った場合には、膜骨格のフェンスに引っかかっても、次のフェンスにぶつかる前にそれを乗り越えることを示唆する。すなわち、フェンスは平均70ミリ秒に一度(=110nm÷1.6 m/s以下の速度でバンド3を引っ張った場合には、膜骨格のフェンスに引っかかっても、次のフェンスにぶつかる前にそれを乗り越えることを示唆する。すなわち、フェンスは平均70ミリ秒に一度(=110nm÷1.6 m/s)、バンド3の細胞質部分を通すほどの大きな構造変化をしていることが示唆された。 m/s)、バンド3の細胞質部分を通すほどの大きな構造変化をしていることが示唆された。 (5)上記の構造変化は、スペクトリンのテトラマーからダイマーへの解離,もしくはテトラマーの構造ゆらぎのどちらかであると考えられる。膜骨格を光ピンセットで引っ張って、30秒以上変形させた後で力を離すと、膜骨格はすぐには元の形に戻らなかった。これは膜骨格の組み替えが生じたためであると考えられ、この結果は、スペクトリンテトラマーとダイマー間の解離/結合が起きていることを示唆するものである。 以上の結果より、赤血球バンド3の運動制御機構は、膜骨格フェンスモデル(図1)によって説明できることが示された。つまり、バンド3の細胞質部分が膜骨格にぶつかることにより、短時間の間は直径110nm程度の領域内部に運動が制限される(その内部では自由拡散をしている)が、膜骨格は動的に揺らいでおり、バンド3は平均して350ミリ秒に一度隣のドメインに移ることができ、それを繰り返しながら広い範囲を運動している、ということが示された。この結果は、膜骨格の側から膜タンパク質の運動性およびその機能を制御する(膜骨格のリン酸化による網目の構造を変化させたり、膜骨格自体を動かしたりすることにより)ことができるという可能性を提示するものである。 |