魚類はわが国を始め、世界中の多くの国で重要な動物性タンパク質資源となっている。数多い食糧魚種のうち、スケトウダラの筋肉はとくに、かまぼこやその関連製品の原科としての価値が高い。ところで、スケトウダラの生息水温は2〜5℃と極めて低く、このような変温動物のタンパク質は、低温でも機能を発揮できるよう柔軟な構造をとることが、種々の実験から示唆されている。このタンパク質は逆に熱に不安定で食品的には問題となる。したがって、その熱安定性を決定する要因を明らかにすることは、食品加工上、有益な基礎的資料を提供することにつながる。しかしながら、熱に不安定なスケトウダラのタンパク質は精製が困難で、その性状は十分には解明されていない。 本研究はこのような背景の下、スケトウダラ筋肉タンパク質の主要成分であるミオシンを対象に、cDNAから一次構造を演繹し他魚種や恒温動物のものと比較した。さらに、大腸菌組換え体で発現させたミオシン・フラグメントの熱力学的性状を調べ、スケトウダラ筋肉ミオシンの構造特異性を分子レベルから明らかにすることを試みた。 1.スケトウダラ筋肉ミオシンのcDNAクローニング 筋肉ミオシンは分子量約50万で、分子量約20万の重鎖サブユニット2本と分子量約2万の軽鎖サブユニット4本から構成される。ミオシン分子は機能および構造的にN末端側で軽鎖を結合している球状のサブフラグメント-1(S1)とC末端側の線維状のロッドに分けられる。ロッドはさらにC端側のL-メロミオシン(LMM)と、このフラグメントとS1をつなぐサブフラグメント-2(S2)にほぼ2等分される。そこで本研究では、スケトウダラ速筋ミオシンの重鎖サブユニットの一次構造をcDNAの塩基配列から演繹することを試みた。 まず、スケトウダラTheragra chalcogramma活魚(平均体重約320g)から速筋を採取し、約1gの大きさにして直ちに液体窒素を用いて急速凍結した。凍結試料は使用まで-80℃に保管した。凍結試料からの全RNAの調製は、チオシアン酸法を用いて行った。この全RNAにつき、NotI-d(T)18プライマーと逆転写酵素を用いてfirst-strand cDNAを合成した。次に、既報の他動物種S2領域のC末端部をコードする塩基配列を参照にプライマーを作成し、先のdTプライマーに相補的なアダプタプライマーとを併用して、first-strand cDNAを鋳型にPCRを行なった。その結果、約1.8kbpのDNA断片が得られた。塩基配列を決定したところ、本DNAは一部S2のコード領域を含むほか、582アミノ酸残基のLMMをコードする1749塩基、さらにはpolyadenylation signalを合むpolyAテールまでの87塩基の3’側非翻訳領域から構成されていた。 さらに、上記DNAのLMMのN末端側をコードする一部塩基配列をプライマーに、他動物種のS1領域をコードする塩基配列を参照して作成したプライマーを用いて、PCRを行ない、約1.8kbpのDNA断片を得た。塩基配列を決定したところ、本DNAは586残基のS2全長をコードしていることが明らかとなり、先の結果と合わせて、ミオシンのロッド部分の全一次構造が決定された。なお、ミオシン重鎖全長のクローニングを試みたが、N末端側のS1重鎖部分をコードするDNA断片は得られなかった。 2.スケトウダラ筋肉ミオシンの一次構造上の特徴 前節で決定されたスケトウダラ速筋ミオシン重鎖の一次構造につき、その特徴を他動物種のものと比較しつつ調べた。まず、S2領域のアミノ酸配列を、既報の他動物種の速筋ミオシンS2と比較した。その結果、スケトウダラS2は、10℃馴化コイ、30℃馴化コイ、ニワトリ、およびウサギの速筋S2とそれぞれ、90.9、91.1、82.5、および84.0%の相同性を示した。したがって、スケトウダラS2は魚類のコイとよく類似し、恒温動物のものとはかなり異なることが明かになった。しかしながら、予想に反して2〜5℃に生息するスケトウダラS2が、10℃に馴化したコイのS2アイソフォームより、より高温の30℃で馴化したコイのものによく類似することがわかった。一般に、体温が低いほど、より熱安定性の低いタンパク質が含まれることから、ミオシン重鎖の一次構造は必ずしも熱安定性のみを反映するものではないと判断された。 次に、LMM部分に関しては、スケトウダラのものは、10℃馴化コイ、30℃馴化コイ、ツナ、ニワトリ、およびウサギ速筋タイプのLMMとそれぞれ、87.4、88.7、89.2、77.9、および77.7%の相同性を示した。これらの結果から、LMMの相同性の比較もS2のそれとほぼ類似した傾向を示すことが明かとなった。 ミオシンのロッドは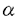 らせんをとる2つの分子が絡み合って、coiled-coilの線維状の構造をとることが既に明らかにされている。このロッドにおけるアミノ酸配列の特徴として、7残基(a,b,c,d,e,f,g)ユニットの繰り返し、さらにこれを4倍した28残基ユニットの繰り返し配列が知られている。なお、aおよびdには疎水性アミノ酸が、eおよびgには酸性または塩基性アミノ酸が配置し、コイルドコイル構造を安定化している。 らせんをとる2つの分子が絡み合って、coiled-coilの線維状の構造をとることが既に明らかにされている。このロッドにおけるアミノ酸配列の特徴として、7残基(a,b,c,d,e,f,g)ユニットの繰り返し、さらにこれを4倍した28残基ユニットの繰り返し配列が知られている。なお、aおよびdには疎水性アミノ酸が、eおよびgには酸性または塩基性アミノ酸が配置し、コイルドコイル構造を安定化している。 スケトウダラ・ミオシンのロッドのアミノ酸配列を、上述のような繰り返しユニットとして整列してみたところ、S2、LMM領域ともに他動物種との有意差は認めらなかった。 3.スケトウダラ筋肉ミオシンの熱力学的性状 前節までにスケトウダラ速筋ミオシンのロッド部分の一次構造が、他動物種のものとはやや異なることが示された。そこで、スケトウダラ速筋からミオシンおよびLMMを調製し、熱力学的性状を調べた。タンパク質調製用の試料としてのスケトウダラ活魚の入手は困難であった。そこで、北方海域で漁獲された極めて新鮮なスケトウダラから船上で製造され、変性防止剤を加えて-20℃で保存された冷凍する身から、速筋ミオシンを調製した。ミオシンはさらに、高イオン強度下、トリプシンで限定分解してLMMとH-メロミオシンに分け、陰イオン交換クロマトグラフィーでLMMを精製した。なお、ミオシンを低イオン強度下、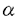 キモトリプシンを用いてS1とロッドに限定分解することを試みたが、ロッドの同時分解が著しく、このタンパク質を調製することはできなかった。 キモトリプシンを用いてS1とロッドに限定分解することを試みたが、ロッドの同時分解が著しく、このタンパク質を調製することはできなかった。 まず、ミオシンにつき、示差走査熱量(DSC)分析に付して得られたデータをコンピュータ解析したところ、28.2、33.7、および41.3℃に吸熱ピークが得られた。このうち、33.7℃の吸熱ピークが最大で、41.3℃のピークがこれに続き、28.2℃のそれは著しく小さかった。なお、別途CD分析したところ、本ミオシンの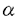 らせん含量は約35%と算定された。他動物種ミオシンの らせん含量は約35%と算定された。他動物種ミオシンの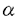 らせん含量は60〜70%と報告されており、スケトウダラ速筋ミオシン標品の らせん含量は60〜70%と報告されており、スケトウダラ速筋ミオシン標品の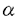 らせん含量はかなり低かった。冷水域に生息する魚類の筋肉からミオシンを高純度、未変性の状態で調製することは極めて難しいとされていることから、本実験でもタンパク質調製中に変性が生じた可能性が考えられた。 らせん含量はかなり低かった。冷水域に生息する魚類の筋肉からミオシンを高純度、未変性の状態で調製することは極めて難しいとされていることから、本実験でもタンパク質調製中に変性が生じた可能性が考えられた。 一方、LMM標品をDSC分析に付したところ、吸熱ピークは29.9、36.7、および44.5℃に観察され、ミオシンの吸熱ピークを示した3つの転移温度(Tm)によく対応した。なお、LMMの吸熱ピークは29.9および44.5℃で大きかったが、36.7℃のものは著しく小さく、したがってDSCパターンはミオシンのものとはかなり様相を異にした。一方、LMMの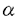 らせん含量は約60%と、ミオシンのそれよりかなり高かったが、既報の他生物種LMMの80〜90%に比べてやはり低かった。なお、本LMM標品の らせん含量は約60%と、ミオシンのそれよりかなり高かったが、既報の他生物種LMMの80〜90%に比べてやはり低かった。なお、本LMM標品の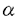 らせんの崩壊温度を種々の温度でCD分析して調べた結果、DSC測定で得られたTmの値とよく一致した。したがって、LMMのDSCにおける吸熱ピークは、 らせんの崩壊温度を種々の温度でCD分析して調べた結果、DSC測定で得られたTmの値とよく一致した。したがって、LMMのDSCにおける吸熱ピークは、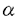 らせんの崩壊で生ずる吸熱反応によるものであることが明らかとなった。 らせんの崩壊で生ずる吸熱反応によるものであることが明らかとなった。 前述のように、スケトウダラ速筋ミオシンおよびLMM標品の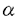 らせん含量が予想に反して低かった。そこで、筋肉からのタンパク質調製の問題点を避けるため、スケトウダラLMMをコードするDNAの大腸菌組換え体から発現タンパク質を得て、その熱力学的性状を調べた。DSC分析の結果、組換え体から発現したLMMは、27.4、30.8、36.5、および43.4℃に吸熱ピークを示し、その大きさは各ピーク間でそれほど大きな差はなかった。また、CD分析の結果から、本LMM標品の らせん含量が予想に反して低かった。そこで、筋肉からのタンパク質調製の問題点を避けるため、スケトウダラLMMをコードするDNAの大腸菌組換え体から発現タンパク質を得て、その熱力学的性状を調べた。DSC分析の結果、組換え体から発現したLMMは、27.4、30.8、36.5、および43.4℃に吸熱ピークを示し、その大きさは各ピーク間でそれほど大きな差はなかった。また、CD分析の結果から、本LMM標品の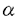 らせん含量は約90%と算定された。本LMM標品のDSC分析でのTmを筋肉から調製したLMM標品(C末端側3kDa程度が欠いている可能性を含む)のそれと比べると、30℃付近のTmは組換え体LMMの方が約1℃高く、逆に、44℃付近のTmは約1℃低かった。一方、C末端側164アミノ酸残基を欠いたLMMを組換え体で発現させ、そのDSC分析を行なったところ、先のLMM全長を含む発現タンパク質でみられた27.4℃の吸熱ピークが観察されなかった。 らせん含量は約90%と算定された。本LMM標品のDSC分析でのTmを筋肉から調製したLMM標品(C末端側3kDa程度が欠いている可能性を含む)のそれと比べると、30℃付近のTmは組換え体LMMの方が約1℃高く、逆に、44℃付近のTmは約1℃低かった。一方、C末端側164アミノ酸残基を欠いたLMMを組換え体で発現させ、そのDSC分析を行なったところ、先のLMM全長を含む発現タンパク質でみられた27.4℃の吸熱ピークが観察されなかった。 以上本研究により、スケトウダラ速筋ミオシン重鎖の部分一次構造が決定され、構造の不安定性を示唆するいくつかの特徴が示された。さらに、ミオシンのC末端側、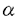 らせん2本のcoiled-coilからなる線維状部分のLMMにつきDSC分析を行ったところ、 らせん2本のcoiled-coilからなる線維状部分のLMMにつきDSC分析を行ったところ、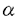 らせんの崩壊による吸熱ピークが観察された。また、LMMのC末端付近の領域は熱力学的性状に大きな影響を及ぼすことが示され、比較生化学上に資するところが大きいと考えられた。なお、スケトウダラ筋肉ミオシンの構造と、加熱ゲル形成などの食品加工上の特性との関係については、今後さらに詳細な検討が必要と考えられる。 らせんの崩壊による吸熱ピークが観察された。また、LMMのC末端付近の領域は熱力学的性状に大きな影響を及ぼすことが示され、比較生化学上に資するところが大きいと考えられた。なお、スケトウダラ筋肉ミオシンの構造と、加熱ゲル形成などの食品加工上の特性との関係については、今後さらに詳細な検討が必要と考えられる。 |