本論文はアントラサイクリン系抗腫瘍抗生物質アクラシノマイシン生産菌であるStreptomyces galilaeusにおけるアクラシノマイシンの生合成過程を遺伝子、酵素レベルで解明することを目的として、アクラシノマイシン、および、そのアグリコンであるアクラビノンの生合成遺伝子系をクローニングし、コードされる生合成関連タンパクの機能を解析したものである。 アントラサイクリン系抗生物質は強力な抗腫瘍活性を持ち、臨床的にも重要な抗生物質であるが、中でも放線菌S.galilaeusの生産するアクラシノマイシンはドキソルビシンなど他のアントラサイクリン類に比べて低心毒性であり、また、急性白血病に著効を示すことが知られている。日本の土壌より分離された本菌のアントラサイクリン生合成遺伝子については、断片的にクローニング、解析されてはいたが、その全容の解明にはほど遠く、また、酵素レベルでの検討もなされていなかった。 本論文は主に2つの部分からなり、1)S.galilaeusのアクラビノン-アクラシノマイシン生合成遺伝子クラスターのクローニングとその解析、および、2)アクラビノンの生合成前駆体であるアクラノン酸合成系を構成する各酵素タンパクの発現とその機能解析である。 1)S.galilaeusのアクラビノン-アクラシノマイシン生合成遺伝子クラスター アクラビノン-アクラシノマイシン生合成遺伝子クラスターをクローニングするため、コスミドベクターpOJ446を用いて、S.galilaeusのゲノムDNAライブラリーを構築、コロニーハイブリダイゼーションならびにPCR法によるスクリーニングを行い、既知の3.4kb BamHI断片を含む約40kbの領域を取得した。各種制限酵素による切断、サブクローニングと塩基配列の決定から、Fig.1に示す制限酵素地図とOpen Reading Frame(ORF)の存在が明らかにされた。各ORFの機能の推定から、アグリコンであるアクラビノン生合成のタイプII型ポリケタイド合成酵素系を構成するaknA〜G,J,X、糖部分の生合成に関わるaclH,K〜N、および、自己耐性遺伝子と考えられるacrO,Pの3つの機能部位からなることが示された。 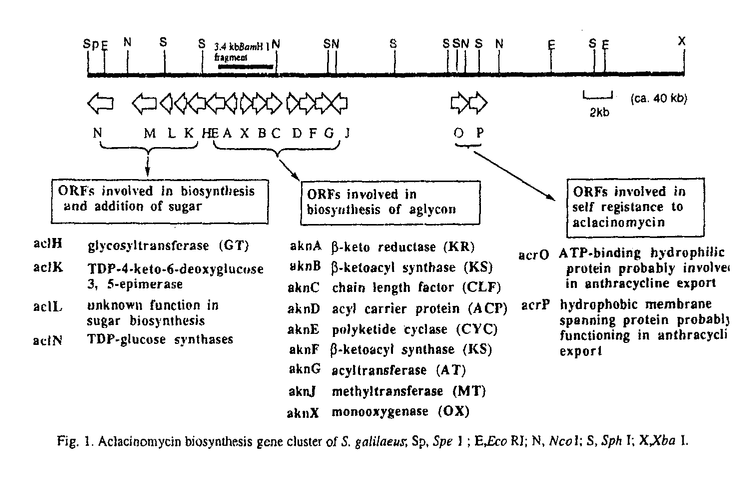 Fig.1.Aclacinomycin biosynthesis gene cluster of S.galilaeus,Sp,Spe l;E,Eco RI;N,Ncol;S,Sph I;X,Xba I. Fig.1.Aclacinomycin biosynthesis gene cluster of S.galilaeus,Sp,Spe l;E,Eco RI;N,Ncol;S,Sph I;X,Xba I. アントラサイクリン抗生物質のアグリコンはいずれもアクラビノンを共通の前駆体として生合成されると考えられており、関連のダウノルビシン、ノガラマイシンなどのポリケタイド合成酵素遺伝子クラスターにおいては、それぞれ特徴的なORFの配置が見られるものの、対応するORFは存在しており、いずれの場合も基本的に同様のポリケタイド合成酵素反応により生合成されるものと考えられる。 2)アクラノン酸合成系を構成する各酵素タンパクの発現とその機能解析 アグリコンであるアクラビノンの前駆体であり、タイプII型ポリケタイド合成酵素系の反応により生成する最初の安定な中間体はアクラノン酸と考えられているが、アクラノン酸生合成のポリケタイド合成酵素の反応系をin vitroで再構成し、各酵素タンパクの機能を解析することを目的として、各酵素タンパクの発現を試みた。 まず、アシルプライマーとマロニル単位の縮合による炭素鎖伸長反応に関与すると考えられている -ketoacyl synthase(KS)であるAknB、chain length factor(CLF)のAknC、およびacyl carrier protein(ACP)のAknDの大腸菌での発現を試みた。T7RNA polymeraseを利用して発現させたAknB(KS)、AknC(CLF)はいずれもinclusion bodyとしてしか得られず、8M ureaで可溶化後、refoldingを試みたところ、AknB(KS)のみ可溶化することができた。AknB(KS)、AknC(CLF)は遺伝子上、translationalにcouplingしており、タンパクとして1:1で存在し、ポリケタイド合成酵素反応に関与しているものと考えられる。そこで、AknB(KS)、AknC(CLF)を1:1共存下でrefoldingを行うことにより、これを安定に可溶化できることを示した。また、抗AknB(KS)抗体を用いた免疫沈降により、refoldingした溶液中でAknB(KS)とAknC(CLF)が1:1でassociateしていることを確認した。また、AknD(ACP)は、phospho-pantetheine転移酵素をco-expressionすることにより、holo-ACPとして得ることができた。以上により、炭素鎖伸長反応に関与する基本タンパクであるKS、CLF、ACPを調製することができたことは、in vitroでのポリケタイド合成酵素反応系再構成に向けての重要な成果と考えられる。 -ketoacyl synthase(KS)であるAknB、chain length factor(CLF)のAknC、およびacyl carrier protein(ACP)のAknDの大腸菌での発現を試みた。T7RNA polymeraseを利用して発現させたAknB(KS)、AknC(CLF)はいずれもinclusion bodyとしてしか得られず、8M ureaで可溶化後、refoldingを試みたところ、AknB(KS)のみ可溶化することができた。AknB(KS)、AknC(CLF)は遺伝子上、translationalにcouplingしており、タンパクとして1:1で存在し、ポリケタイド合成酵素反応に関与しているものと考えられる。そこで、AknB(KS)、AknC(CLF)を1:1共存下でrefoldingを行うことにより、これを安定に可溶化できることを示した。また、抗AknB(KS)抗体を用いた免疫沈降により、refoldingした溶液中でAknB(KS)とAknC(CLF)が1:1でassociateしていることを確認した。また、AknD(ACP)は、phospho-pantetheine転移酵素をco-expressionすることにより、holo-ACPとして得ることができた。以上により、炭素鎖伸長反応に関与する基本タンパクであるKS、CLF、ACPを調製することができたことは、in vitroでのポリケタイド合成酵素反応系再構成に向けての重要な成果と考えられる。 また、aknB(KS)の直ぐ上流に位置するaknX遺伝子について、当初その機能は未知であったがテトラシノマイシン生合成のtcmH遺伝子との相同性が認められたことから類似の酸素添加酵素をコードするものと推定し、その確認のため、AknXタンパクの大腸菌での発現を行った。本来の基質と考えられるアクラノン酸のアンスロン体が入手できなかったため、エモジンアンスロンを基質として発現タンパクの酵素活性を検討し、これがアンスロンからアントラキノンへの酸素添加酵素であることを明らかにした。また、類似のTcmHタンパクと同様に金属、補酵素の関与が認められておらず、AknXによる酸素添加反応の反応機構を探るため、部位特異的に変異導入した変異タンパクを発現させ、その反応の速度論解析を行った。その結果、Trp-67が酸素添加活性に重要な役割をしていることが明らかになった。このTrp-67の関与を含め、AknXタンパクの3次元構造の解明を目的に本酵素の大量精製を行い、種々結晶化条件を検討したが、現在のところ、X線結晶構造解析に適する結晶を得るには至ってはいない。 以上のように本研究は、アントラサイクリン系抗腫瘍抗生物質アクラシノマイシンの生合成遺伝子クラスターのほぼ全容を初めて明らかにするとともに、アグリコンであるアクラビノン生合成に関与する基本酵素タンパクを発現させ、in vitroでの再構成系確立への途を拓いたものと考えられ、更に詳細な解析と新たな抗生物質生産系開発へと展開することが期待される。このように本研究は天然物化学、抗生物質学に寄与するところが大きく博士(薬学)の学位に値すると認めた。 |