種々の細胞膜7回貫通型受容体は、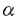   サブユニットからなる三量体Gタンパク質を介して細胞内にシグナル分子を生産する酵素やイオンチャネルにその情報を伝達している。アゴニストがこのタイプの受容体に結合すると、Gタンパク質はGTPの結合した サブユニットからなる三量体Gタンパク質を介して細胞内にシグナル分子を生産する酵素やイオンチャネルにその情報を伝達している。アゴニストがこのタイプの受容体に結合すると、Gタンパク質はGTPの結合した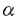 サブユニットと サブユニットと  サブユニットに解離するが、近年 サブユニットに解離するが、近年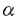 サブユニットに加えて、 サブユニットに加えて、  サブユニット(G サブユニット(G  )もいくつかのエフェクター分子の活性を直接制御することが見出されてきた。G )もいくつかのエフェクター分子の活性を直接制御することが見出されてきた。G には、一次構造上約40アミノ酸単位からなるWDモチーフと呼ばれるユニークな配列( には、一次構造上約40アミノ酸単位からなるWDモチーフと呼ばれるユニークな配列( シート→ターン→ シート→ターン→ シート→ターンと続く)が7回繰り返して存在している。最近のX線構造解析から、G シート→ターンと続く)が7回繰り返して存在している。最近のX線構造解析から、G はN末端側からの はN末端側からの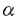 ヘリックスに続いて、WDモチーフの1つがプロペラの羽根構造を形成し、全体として7枚羽根の ヘリックスに続いて、WDモチーフの1つがプロペラの羽根構造を形成し、全体として7枚羽根の プロペラー様構造をとるように配置されていることが示された(図1)。 プロペラー様構造をとるように配置されていることが示された(図1)。  図1 G- 図1 G-  サブユニットの サブユニットの プロペラ様構造 プロペラ様構造 そこで私は、G  の構造と機能をより詳細に解析する目的から、動物細胞でのインタクトなG の構造と機能をより詳細に解析する目的から、動物細胞でのインタクトなG  複合体の発現系を確立し、G 複合体の発現系を確立し、G のWDモチーフに変異を導入した種々の組換え体を作製してG のWDモチーフに変異を導入した種々の組換え体を作製してG  で直接活性化される酵素に与える影響を異なる手法で検討した。その結果、G で直接活性化される酵素に与える影響を異なる手法で検討した。その結果、G  -エフェクター間の結合において、G -エフェクター間の結合において、G の7つのWDモチーフがエフェクターの種類によって使い分けられていることを見出した。さらに、G の7つのWDモチーフがエフェクターの種類によって使い分けられていることを見出した。さらに、G  で活性化されるイノシトールリン脂質3キナーゼ(PI3K)側の機能部位についても検討を加えた。 で活性化されるイノシトールリン脂質3キナーゼ(PI3K)側の機能部位についても検討を加えた。 1.COS-7培養細胞におけるG  複合体の発現:発現G 複合体の発現:発現G  の性状解析 の性状解析 2種の異なるサブユニットからなり、その サブユニットがイソプレニル化されるG サブユニットがイソプレニル化されるG  の発現系としては、バキュロウイルスなどが利用されてきたが、多種の変異体の調製には必ずしも適当な系とは考えられない。そこで私は、エレクトロポレーション法を用いてCOS-7細胞にタグ付きG の発現系としては、バキュロウイルスなどが利用されてきたが、多種の変異体の調製には必ずしも適当な系とは考えられない。そこで私は、エレクトロポレーション法を用いてCOS-7細胞にタグ付きG とG とG のcDNAを同時に導入し、G のcDNAを同時に導入し、G  を発現したCOS-7細胞からタグを利用してG を発現したCOS-7細胞からタグを利用してG  を精製した。さらに脂質ミセルによって沈降濃縮させる手法を用いて、比較的短時間で高濃度のG を精製した。さらに脂質ミセルによって沈降濃縮させる手法を用いて、比較的短時間で高濃度のG  標品を得ることに成功した。 標品を得ることに成功した。 得られたタグ付きG  がインタクトな構造であり がインタクトな構造であり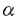 サブユニットと会合し得ることは、百日咳毒素によるG サブユニットと会合し得ることは、百日咳毒素によるG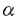 サブユニットのADPリボシル化で確認した。G サブユニットのADPリボシル化で確認した。G  で活性化されることが知られているヘテロダイマー型(p110 で活性化されることが知られているヘテロダイマー型(p110 /P85)のイノシトールリン脂質3キナーゼ(PI3K)にこのG /P85)のイノシトールリン脂質3キナーゼ(PI3K)にこのG  標品を添加してPIP3産生量を測定した結果、確かにPI3Kの活性化が認められた。 標品を添加してPIP3産生量を測定した結果、確かにPI3Kの活性化が認められた。 2.G  によるアデニル酸シクラーゼの活性化:各種のG によるアデニル酸シクラーゼの活性化:各種のG  キメラ体を用いた解析 キメラ体を用いた解析 G のWDモチーフの役割を検討するために、1〜7のそれぞれのWDモチーフのコア領域をホスフォリパーゼA活性化タンパク質の第5WDモチーフに置換した遺伝子を構築した(図2)。2型のアデニル酸シクラーゼは、GSの のWDモチーフの役割を検討するために、1〜7のそれぞれのWDモチーフのコア領域をホスフォリパーゼA活性化タンパク質の第5WDモチーフに置換した遺伝子を構築した(図2)。2型のアデニル酸シクラーゼは、GSの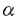 サブユニットによって活性化され、 サブユニットによって活性化され、  サブユニットによってその活性がさらに増強される特性をもつことが知られている。そこでアデニル酸シクラーゼに対するG サブユニットによってその活性がさらに増強される特性をもつことが知られている。そこでアデニル酸シクラーゼに対するG  のWDモチーフ相互作用部位を検討するために、COS-7細胞にアデニル酸シクラーゼ(2型)のcDNAと、タグ付きのG のWDモチーフ相互作用部位を検討するために、COS-7細胞にアデニル酸シクラーゼ(2型)のcDNAと、タグ付きのG またはG またはG キメラ体のcDNA、さらにG キメラ体のcDNA、さらにG のcDNAを同時に導入した。導入COS-7細胞を のcDNAを同時に導入した。導入COS-7細胞を 受容体アゴニストのイソプロテレノールで刺激してGSの 受容体アゴニストのイソプロテレノールで刺激してGSの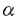 サブユニットを解離させ、各種のG サブユニットを解離させ、各種のG  キメラ体による増強効果を検討した。その結果、図3に示すように、アデニル酸シクラーゼ(2型)はG キメラ体による増強効果を検討した。その結果、図3に示すように、アデニル酸シクラーゼ(2型)はG の第1WDモチーフを中心として相互作用していることが示された。 の第1WDモチーフを中心として相互作用していることが示された。  図2 G 図2 G 2とPLA活性化タンパク質とのキメラ体 2とPLA活性化タンパク質とのキメラ体 図3 G 図3 G  キメラ体による2型アデニル酸シクラーゼの活性化:第1WDモチーフの関与3.G キメラ体による2型アデニル酸シクラーゼの活性化:第1WDモチーフの関与3.G  とRaf-1キナーゼとの会合:酵母のtwo-hybrid系を用いた解析 とRaf-1キナーゼとの会合:酵母のtwo-hybrid系を用いた解析 Raf-1キナーゼはCキナーゼやRasを介したMAPキナーゼカスケードにおい重要な役割を担うセリン/スレオニンキナーゼであるが、その活性化経路には不明な点も残されている。膜移行シグナルを付加した実験等からRaf-1の細胞膜への移行が活性化に重要であると考えられているが、この点と関連して、最近Raf-1キナーゼのN末端調節領域とG のC末端部位との結合が、酵母のtwo-hybrid系あるいは精製タンパク質を用いた系で報告された。そこで私は、このRaf-1キナーゼに対するG のC末端部位との結合が、酵母のtwo-hybrid系あるいは精製タンパク質を用いた系で報告された。そこで私は、このRaf-1キナーゼに対するG 上の結合部位を調べるために、先ずC末端側3単位からなるWDモチーフを2種類作製し、Raf-1キナーゼのN末端領域との相互作用を酵母のtwo-hybrid系を用いて検討した。その結果、図4に示すように、第4〜7WDモチーフ間で相互作用することが確認できた。さらにその部位を特定する目的で、1単位のみからなる各種のWDモチーフを作製して検討を加えた結果、Raf-1キナーゼはC末端側の第6WDモチーフ以外に、第3WDモチーフとも相互作用する可能性が新たに見出された。 上の結合部位を調べるために、先ずC末端側3単位からなるWDモチーフを2種類作製し、Raf-1キナーゼのN末端領域との相互作用を酵母のtwo-hybrid系を用いて検討した。その結果、図4に示すように、第4〜7WDモチーフ間で相互作用することが確認できた。さらにその部位を特定する目的で、1単位のみからなる各種のWDモチーフを作製して検討を加えた結果、Raf-1キナーゼはC末端側の第6WDモチーフ以外に、第3WDモチーフとも相互作用する可能性が新たに見出された。  図4 酵母のTwo-hybrid系を用いたG 図4 酵母のTwo-hybrid系を用いたG とRaf-1との結合部位の解析4.G とRaf-1との結合部位の解析4.G  によるイノシトールリン脂質3キナーゼ(PI3K)の活性化 によるイノシトールリン脂質3キナーゼ(PI3K)の活性化 PI3KはPI,PI(4)P,PI(4,5)P2を基質として、そのイノシトール環3位をリン酸化する酵素であり、細胞の分化、増殖などに重要な役割を果たす脂質キナーゼである。PI3Kにはアイソザイムが存在するが、当教室ではヘテロダイマー型のPI3K(p110 /P85)がG /P85)がG  とチロシンリン酸化ペプチドによって相乗的に活性化されることを見出している。そこで、調節サブユニットp85の一部を付加した恒常的活性化型p110 とチロシンリン酸化ペプチドによって相乗的に活性化されることを見出している。そこで、調節サブユニットp85の一部を付加した恒常的活性化型p110 とp110 とp110 の変異体をそれぞれTHP-1細胞に遺伝子導入し(図5)、受容体刺激によるPI3Kの活性化を無傷細胞のレベルで検討した。その結果、活性化型p110 の変異体をそれぞれTHP-1細胞に遺伝子導入し(図5)、受容体刺激によるPI3Kの活性化を無傷細胞のレベルで検討した。その結果、活性化型p110 を発現した時に、Gタンパク質共役型fMLP受容体の刺激で細胞内にPIP3産生が観察され、G を発現した時に、Gタンパク質共役型fMLP受容体の刺激で細胞内にPIP3産生が観察され、G  は調節サブユニットであるp85側ではなく、触媒サブユニットであるp110 は調節サブユニットであるp85側ではなく、触媒サブユニットであるp110 に作用することが示された。 に作用することが示された。  図5 p110 図5 p110 -PI3K遺伝子導入によるfMLP受容体刺激を介する細胞内PIP産生の増大5.まとめ -PI3K遺伝子導入によるfMLP受容体刺激を介する細胞内PIP産生の増大5.まとめ 本研究において私は、G のWDモチーフに変異を導入した種々の組換え体を用いて、アデニル酸シクラーゼ、Raf-1キナーゼに対する影響を検討し、G のWDモチーフに変異を導入した種々の組換え体を用いて、アデニル酸シクラーゼ、Raf-1キナーゼに対する影響を検討し、G  -エフェクター間の結合においては、G -エフェクター間の結合においては、G の7つのWDモチーフがエフェクターの種類によって使い分けられていることを見出した。さらに、G の7つのWDモチーフがエフェクターの種類によって使い分けられていることを見出した。さらに、G  で活性化されるイノシトールリン脂質3キナーゼ(PI3K)についても検討を加え、G で活性化されるイノシトールリン脂質3キナーゼ(PI3K)についても検討を加え、G  がPI3Kの触媒サブユニットであるp110 がPI3Kの触媒サブユニットであるp110 上の機能部位に作用することを見出した。 上の機能部位に作用することを見出した。 |