細胞の増殖・分化の機構を解明するためには、細胞周期の制御機構を明らかにする必要がある。高等動物に比べ、遺伝学的手法が有効な酵母においては細胞周期関連遺伝子群、栄養増殖期と接合や減数分裂などのスイッチングに働く遺伝子群など詳細に調べられつつある。CDC2及びWEE1、CDC25のクローニングからも分かるように、細胞周期の主要な制御因子は分裂酵母から高等動物まで種を越えて保存されている。この様な理由から我々の研究室では、細胞周期制御に関わる主要な遺伝子を単離するための方法として、分裂酵母及び高等動物のcDNAライブラリーを分裂酵母変異株に導入し、その表現型を抑圧する遺伝子をスクリーニングするシステムを用いている。 増殖と分化のスイッチングの制御はG1期に起こると考えられ、これに関わる遺伝子を単離するため、私は分裂酵母のG1期変異株pat1をスクリーニングの宿主とした。 通常分裂酵母では、栄養源の枯渇等に反応してG1期で増殖を停止し、接合・減数分裂・胞子形成という一連の過程(性分化)に入るが、私はこれを細胞分化のプロトタイプと考えている。増殖中の分裂酵母においては、性分化の系への進行はpat1+遺伝子産物によって抑えられている(右図)。このpat1温度感受性変異株は制限温度にすると一倍体のまま胞子形成を始め致死となる。つまりpat1+遺伝子は増殖と分化の分岐点を制御しており、この変異株を宿主としたスクリーニングではpat1+ホモログ以外にも増殖と分化を制御する様々な遺伝子が得られると予想された。 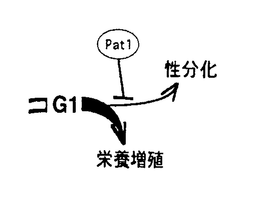 図表 図表 実際に上記の方法で単離された、新しい分裂酵母の遺伝子nrd1+は分化の制御因子であり、性分化の最初のステップである「接合」を阻害することが明らかになっている。このNrd1は、今回私が単離した高等動物の遺伝子Rod1と、構造的に似たRNA結合蛋白であり、同じ分裂酵母の宿主を用いて単離され、その他種々の分裂酵母の変異株に対する抑圧能も同じであることなどから、互いにホモログであると考えられた。 nrd1遺伝子破壊株は野性株に比べて極めて接合し易い性質を示し、野生株では接合が誘導されないような弱い栄養源飢餓状態においても速やかに性分化の系に入る。一方、nrd1+を過剰発現させた野性株は、栄養源飢餓による分化誘導に対して、それまでよりも耐性を示すようになる。このことからNrd1は、分化誘導の刺激に対する閾値を上げていると考えられる。nrd1遺伝子破壊株の分化し易さは、外からnrd1+自身を導入・発現させることによって、再び野性株レベルに戻すことが出来る。 このことは高等動物由来のROD1遺伝子を過剰発現させた場合にも可能であった。 nrd1+遺伝子産物の分化の制御因子としての機能は、分化誘導の中心的役割を担うSte11に対する何らかの阻害作用によるものと考えられるが、少なくともRNAレベルではnrd1+過剰発現によるste11+の抑制は見られない。しかし転写因子Ste11の下流の因子については、nrd1+の過剰発現によって、それらの発現が抑制されることが確認されている。中でもPファクター/Mファクターといった接合因子に特異的に誘導されるsxa2+、rep1+などの遺伝子の発現抑制が顕著である。この場合もROD1はnrd1+と同様に、ste11+の発現は抑制せず、その下流の接合因子依存的な遺伝子について発現を抑制した。 以上、分裂酵母を用いた一連の実験は、高等動物の遺伝子ROD1が分裂酵母の遺伝子nrd1+と同じ作用機序によって分化を抑制することを示唆している。 ROD1遺伝子の機能を本来の生物種、高等動物細胞で解析するため、まず最初にラットの臓器を用いてその局在を検討した。その結果、胎児ラットでは比較的広範囲の臓器で発現が見られたにもかかわらず、生後5週令のラットでは膵臓、胸腺、骨髄など血球系細胞を多く含む臓器において発現が高くなっていた。 この結果を踏まえ、ROD1が実際に動物細胞中で分化抑制因子としての機能を果たすか否か、血球系培養細胞を用いて解析した。用いたのはヒト慢性骨髄性白血病由来のK562細胞で、この細胞はホルボールエステルによって巨核球へ、また酢酸ブチルによっては赤芽球に分化するなど多方向へ分化する能力を有している。この細胞にROD1遺伝子を導入し、安定な高発現細胞株を複数株樹立した後、分化誘導時の反応性をコントロール群と比較検討した。K562細胞をホルボールエステルで処理し、巨核球への分化に特異的な表面抗原マーカー/CD61の発現パターンをフローサイトメトリーによって比較した。それによるとROD1高発現株はコントロール群に比べて明らかに分化誘導されにくい性質を示していた。これは比較的早期のマーカーであるCD61ばかりでなく、CD61よりも発現時期の遅い表面抗原マーカー/CD49bを用いた場合にも同様であった。また、巨核球は血小板産生細胞であり、K562細胞においても巨核球への分化がスタートすると24時間以内に血小板由来増殖因子(PDGF)の発現が確認される。このPDGFについても、ROD1高発現株はコントロール群に比べて、顕著にその発現が抑えられていた。これらの結果からROD1はホルボールエステルによる巨核球分化を抑制することがわかった。 このROD1の抑制はホルボールエステル特異的なものではないことが、酢酸ブチルを用いて赤芽球へ分化させた場合の効果を検討することによって明らかとなった。赤芽球分化に伴い細胞内に蓄積されるヘモグロビンは、検出試薬ジアミノフルオレンを加え、その際に発色するフルオレンブルーの吸光度を測定することで検出可能である。その結果、ROD1高発現株ではコントロール群に比べて圧倒的にこのヘモグロビン含有量が少なく、ホルボールエステルの場合と同様に、酢酸ブチルによる赤芽球分化をも抑制されることがわかった。このようにROD1は、K562の赤芽球分化においても、また巨核球分化においても分化抑制因子として機能することが確認された。 以上のようにROD1が分裂酵母及び高等動物細胞で分化抑制因子として機能するという事実は、分化の制御系が種を越えて保存されている可能性を示唆している。これを更に強く支持する証拠としては、近年我々の研究グループが単離した分裂酵母のste11+活性化因子rcd1+、phh1+の存在が挙げられる。前者はその一次配列が分裂酵母から高等動物まで文字通り保存されており、今後の機能的な解析結果が待たれるところである。またPhh1は典型的なMAP kinaseであり、出芽酵母のHog1、哺乳類のp38と高い相同性を示す。これらの遺伝子のストレスに応答したキナーゼ活性の上昇は周知の事実であり、更に高等動物細胞ではある種の分化に積極的に関与するという報告もある。転写因子Ste11は、高等動物においてT細胞分化に必須のTcf-1などと同様にHMGボックス配列を含んでおり、これらHMGボックス配列を含む遺伝子群は、分化に積極的に関与することが報告されている。下図に示すように分化の主要因子Ste11を中心に、抑制する系としてのcAMP-Pka1そしてNrd1、逆に活性化する系としてRcd1、Phh1、それぞれの機能に対応する高等動物の遺伝子が存在するのは非常に興味深い。 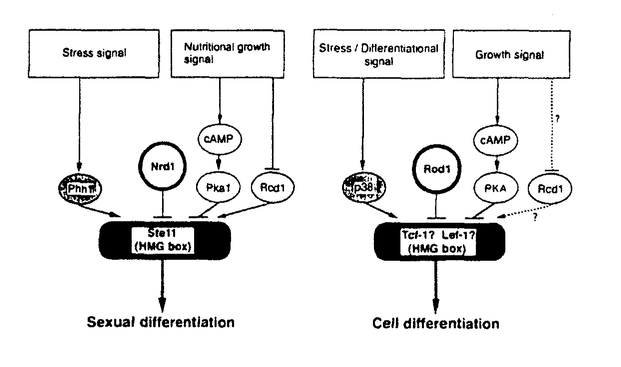 図表 図表 高等動物における分化は多岐に渡り、その制御についても単細胞生物のそれに比べて圧倒的に複雑になっているのは当然である。しかし高等動物もその基本単位は細胞であり、生物の根幹を担う増殖と分化の基本的制御は、種を越えて広く保存されていたとしても不思議ではない。今はまだ仮説の域を出ないが今後、増殖と分化の制御に関わる因子がさらに多く単離され、それらについての解析が進められることによって「基本的制御系の種を越えた類似性」が明らかになっていくものと期待している。この論文が、将来において一つの布石としての役割を果たすことが出来れば幸いである。 |