本論文は3章からなり、オキシムsp2窒素原子上での分子内SN2型反応およびラジカル環化反応による複素環化合物の合成法の開発について述べたものである。第一章はオキシムsp2窒素原子上での分子内SN2型反応による環状イミン合成法の開発について、第二章は2-(3-ヒドロキシフェニル)エチルケトンO-2,4-ジニトロフェニルオキシムの環化による8-ヒドロキシキノリン合成法の開発について、第三章はアルキリデンアミニルラジカルの分子内付加反応による環状イミン合成法の開発について述べている。 第一章では、オキシムsp2窒素原子上での分子内SN2型反応による、O-メチルスルホニルオキシムからの環状イミンの合成について述べている。Beckmann転位反応はオキシムからのアミドの合成反応として広く利用されているが、Beckmann転位を伴わないオキシム窒素原子上での置換反応は困難とされ、合成反応としては注目されていなかった。本著者は、4位にシロキシ基をもつフェネチルケトンのO-メチルスルホニルオキシム1にCsFを作用させると、Beckmann転位を起こさずにオキシム窒素原子上での環化が進行し、スピロ化合物2が77%の収率で生成することを見いだした(式1)。 また、4-ヒドロキシフェネチルケトンオキシムとプロトン酸との反応および分子軌道法計算による検討から、従来起こり難いとされたオキシムsp2窒素原子上での分子内SN2型反応が、Beckmann転位と同様容易に進行し得ることを明らかにしている。 上記の反応ではフェノキシドが分子内求核種として作用したが、これに代えマロン酸エステル部位を有するE体のO-メチルスルホニルオキシム3を1,8-ジアザビシクロ[5.4.0]-7-ウンデセン(DBU)で処理すると、オキシム窒素原子上で置換反応が効率良く進行し、3,4-ジヒドロ-2H-ピロール4が良好な収率で得られることを見いだしている(式2)。また、この環化反応では6員環化合物である2,3,4,5-テトラヒドロピリジンの合成も可能である。 第二章では、2-(3-ヒドロキシフェニル)エチルケトンO-2,4-ジニトロフェニルオキシムの環化反応による、8-ヒドロキシキノリンの合成について述べている。O-2,4-ジニトロフェニルオキシム5にNaHを作用させた後、one-potで酢酸酸性下2,3-ジクロロ-5,6-ジシアノ-p-ベンゾキノン(DDQ)を加えて酸化処理を行うと、8-ヒドロキシキノリン6が収率良く合成できることを見いだしている(式3)。本反応では位置選択的に環化が進行し、8-ヒドロキシキノリンを単一生成物として得ることに成功している。 また、反応機構の検討から、本反応は式4に示すようなフェノール環から2,4-ジニトロフェニル基への一電子移動によって生じるアルキリデンアミニルラジカルの分子内カップリング反応であることを明らかにしている。 第三章では、 , ,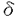 -不飽和ケトンO-2,4-ジニトロフェニルオキシムの一電子還元により生成するアルキリデンアミニルラジカルの分子内付加反応を利用する環状イミンの合成について述べている。オキシム7に各種ラジカル捕捉剤存在下でNaHと3,4-メチレンジオキシフェノールを作用させると、生成するアルキリデンアミニルラジカルの分子内付加が進行し、環化体8が良好な収率で得られることを見いだしている。このとき、ラジカル捕捉剤として、1,4-シクロヘキサジエン、四塩化炭素、ジフェニルジスルフィド、ジフェニルジセレニドを用いることができ、環化中間体Aに様々なヘテロ原子官能基を導入することも可能である(式5)。 -不飽和ケトンO-2,4-ジニトロフェニルオキシムの一電子還元により生成するアルキリデンアミニルラジカルの分子内付加反応を利用する環状イミンの合成について述べている。オキシム7に各種ラジカル捕捉剤存在下でNaHと3,4-メチレンジオキシフェノールを作用させると、生成するアルキリデンアミニルラジカルの分子内付加が進行し、環化体8が良好な収率で得られることを見いだしている。このとき、ラジカル捕捉剤として、1,4-シクロヘキサジエン、四塩化炭素、ジフェニルジスルフィド、ジフェニルジセレニドを用いることができ、環化中間体Aに様々なヘテロ原子官能基を導入することも可能である(式5)。 さらに、オキシム9のラジカル環化を鍵として利用し、ピロリジジンアルカロイドxenovenine12の合成に成功している(式6)。この検討過程で、ジヒドロピロール10をエンカルバマートに導き酢酸中水素化ホウ素ナトリウムで還元すると、2,5-トランス二置換ピロリジン11が単一生成物として得られることを明らかにしている。このように、従来困難であった2,5-二置換ジヒドロピロールをトランス選択的に還元する手法も開発している。 以上、本著者は、これまで合成反応としてほとんど利用されていなかったオキシムsp2窒素原子上での分子内SN2型反応およびアルキリデンアミニルラジカルの環化反応を利用し、オキシムから8-ヒドロキシキノリンや環状イミンなどの含窒素複素環化合物の簡便な合成法を開発している。この独創的な合成反応の開拓は有機合成化学の分野に貢献すること大である。なお、本研究は林雄二郎、小野あや子、吉田将之、奈良坂紘一との共同研究であるが、論文提出者の寄与は十分であると判断する。従って、博士(理学)の学位を授与できるものと認める。 |