学位論文要旨
| No | 114105 | |
| 著者(漢字) | 伊藤,俊樹 | |
| 著者(英字) | Itoh,Toshiki | |
| 著者(カナ) | イトウ,トシキ | |
| 標題(和) | 新規ホスファチジルイノシトール5-リン酸4-キナーゼは小胞体内に局在し、リン酸化を受けて機能する | |
| 標題(洋) | A novel phosphatidylinositol 5-phosphate 4-kinase (PIPK II 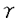 )is phosphorylated in the endoplasmic reticulum in response to mitogenic signals )is phosphorylated in the endoplasmic reticulum in response to mitogenic signals | |
| 報告番号 | 114105 | |
| 報告番号 | 甲14105 | |
| 学位授与日 | 1999.03.29 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(理学) | |
| 学位記番号 | 博理第3594号 | |
| 研究科 | 理学系研究科 | |
| 専攻 | 生物化学専攻 | |
| 論文審査委員 | ||
| 内容要旨 | ホスファチジルイノシトール4,5二リン酸(以下PI(4,5)P2)は細胞内において多様な機能を持つリン脂質である。PI(4,5)P2の最もよく理解されている機能は、特異的ホスホリパーゼC(PLC)による水解を受けてジアシルグリセロール(DG)、イノシトール三リン酸(IP3)の2つのセカンドメッセンジャーを産生し、それぞれプロテインキナーゼC(PKC)の活性化、細胞内カルシウムの動員を引き起こすことである。しかしPI(4,5)P2は、多くのアクチン調節蛋白に結合してその活性を制御し細胞骨格構造変化に重要な役割を果たしていること、神経細胞におけるエキソサイトーシスや分泌などの膜輸送に必須であることなど、セカンドメッセンジャー産生以外にも多様な機能を持つことが明らかになっている。このようなPI(4,5)P2の多様な機能の発現に対応して、細胞内の特定の場において特定の機構に制御されたPI(4,5)P2合成酵素群が存在すると考えられる。中でもPI(4,5)P2合成の最終段階を担うPIPキナーゼは、その分子レベルでの解析がPI(4,5)P2の機能発現の制御機構を明らかにする上で非常に重要である。哺乳類のPIPキナーゼには大きく分けて2つのサブタイプ(type I、type II)が存在する。Type IがPI4P→PI(4,5)P2という反応を行うのに対して、type IIはPI5P→PI(4,5)P2という反応によりPI(4,5)P2合成を行うなど、各PIPキナーゼアイソフォームはそれに伴うPI(4,5)P2産生経路の多様性を実現しており、ホスホイノシチドの細胞内での多様な機能発現に重要な意味を持つと考えられる。本研究において私は、PIPキナーゼの細胞内機能の解明を目的とし新規PIPキナーゼの同定を試みた。 哺乳類PIPキナーゼ及び酵母におけるそのホモログであるMSS4、FAB1の一次構造上高度に保存されたアミノ酸配列(D/E)YCPXVFR、MDYSLLLG(I/M)(X:任意のアミノ酸)に相当するPCRプライマーを作製した。このプライマーを用いてラット脳cDNAを鋳型としてPCRを行い、新たなPIPキナーゼをコードすると思われる配列を得た。さらにこのcDNA配列をプローブとしてラット脳cDNAライブラリーのスクリーニングを行い完全長のcDNAを得ることに成功した。cDNAは1260bp、420アミノ酸をコードし、その配列はPIPKII   はPI5P4-キナーゼである はPI5P4-キナーゼである 次にPIPKII   の酵素活性 の酵素活性 は増殖刺激に伴いリン酸化される は増殖刺激に伴いリン酸化される COS-7細胞内に過剰発現させたPIPKII   のウェスタンブロッティング(B)アルカリホスファターゼ処理による脱リン酸化(C)増殖刺激によるPIPKII のウェスタンブロッティング(B)アルカリホスファターゼ処理による脱リン酸化(C)増殖刺激によるPIPKII のリン酸化の上昇 のリン酸化の上昇 は小胞体内に局在している は小胞体内に局在している 次にPIPKII   の細胞内局在 の細胞内局在 本研究において私は新規PIPキナーゼ(PIPKII また私は細胞免疫染色法およびショ糖密度勾配遠心法により、PIPKII | |
| 審査要旨 | 本論文は新規ホスファチジルイノシトールーリン酸キナーゼ(PIPキナーゼ)のcDNAクローニングと、その機能解析について述べられている。PIPキナーゼは細胞内セカンドメッセンジャー産生脂質として重要な役割を担うリン脂質、ホスファチジルイノシトール4,5二リン酸(PI(4,5)P2)を産生する酵素である。PI(4,5)P2はセカンドメッセンジャー産生だけではなくアクチン細胞骨格の再構成や細胞内小胞輸送など様々な現象に関与し、多様な細胞内機能を持っている。論文提出者は、このような多様なPI(4,5)P2の機能発現においてはその産生酵素であるPIPキナーゼ分子種の多様性が寄与していると考え、新たなPIPキナーゼの探索を行い、新規PIPキナーゼのクローニングに成功した。細胞内情報伝達に関わるタンパクキナーゼ、脂質キナーゼは、基質となるタンパク、脂質が同一の場合でも、その制御機構や個々のキナーゼが関与する細胞内現象などによって別個のアイソフォームを有するキナーゼファミリーを形成していることが多い。また、多様なPI(4,5)P2の細胞内機能、細胞内局在などを考えた場合、その合成キナーゼであるPIPキナーゼがそれに対応した多様性を示すという発想は適切であり、評価する。 本研究はPIPキナーゼの新規アイソフォームを探索するために、既知のPIPキナーゼの一次構造比較に基づいたdegenerate RT-PCR法という一般的な方法を用いており、その後のcDNAクローニングも定法に従って適切に実験を進めている。クローニングされた新規PIPキナーゼ(PIPKII 本研究ではクローニングされたPIPKII さらに本研究において明らかにされた最も特筆すべき知見は、PIPKII 本研究はPI(4,5)P2の機能の多様性を説明する仮説の設定、新規PIPキナーゼアイソフォームの同定、その機能解析による仮説の裏付けへという流れを持って進められており、また、一つ一つの実験データも明確でそれらの解釈も無理がなく適切である。以上の評価から本研究は博士の学位にふさわしいと判断できる。 なお、本論文は伊集院壮氏との共同研究であるが、論文提出者が主体となって分析及び検証を行ったもので、論文提出者の寄与が十分であると判断する。 したがって、博士(理学)の学位を授与できると認める。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/54683 |
 、
、 とそれぞれ61.1%、63.7%の相同性を有していたため、この新規PIPキナーゼをPIPKII
とそれぞれ61.1%、63.7%の相同性を有していたため、この新規PIPキナーゼをPIPKII