| 内容要旨 | | 序 RNA結合ドメイン(RNA-binding domain,以下RBDと略記)は,およそ80-90アミノ酸残基にわたるゆるい保存性を持つドメインであり,一般に1本鎖RNAとの結合能を有すると考えられている.現在ではホモロジー検索により,真核生物のおびただしい種類のタンパク質にRBDが存在することが知られており,これらのタンパク質がRNAの転写から翻訳に至る様々な段階でRNA代謝制御系を形成していると推定されている.興味深いことに,RBDを有するタンパク質の多くは,1つのタンパク質分子あたり複数個のRBDを持つ傾向があるが,これまでのところその意義は不明であった.本研究ではRBDの持つこの特徴に着目し,複数個のRBDによる1本鎖RNA認識機構を,NMR法を用いて立体構造の面から解析した.さらにその結果に基づき,RBDがタンパク質1分子あたり複数個見いだされる意義を考察した. RBDを持つタンパク質は非常に多くの種類が知られているが,実際に生物学的機能や結合RNA配列が明らかになっている例は少ない.本研究では,機能や結合RNA配列が比較的明らかになっている2種類のタンパク質(Sex-lethal,HuC)に着目し,それらのRBDを解析対象とした.Sex-lethalタンパク質(Sxl)はDrosophilaの性決定に関与するRNA結合タンパク質であり,タンパク質内にタンデムにつながった2つのRBD(Sxl RBD1-RBD2)がtransformer pre-mRNAの3’スプライス部位近傍の配列GUUUUUUUUに結合することにより,選択的スプライシングを制御することが知られている.一方HuCは,高等動物の神経細胞に特異的に見いだされるタンパク質で,3つのRBD(HuC RBD1,RBD2,RBD3)を持ち,うちN末端側のタンデムにつながった2つのRBD(HuC RBD1-RBD2)がmRNAの3’非翻訳領域のAU3-4配列の繰り返し(AU-rich element,ARE)に結合することでmRNAの寿命を制御することが知られている.これら2つのタンパク質は生物学的機能も結合RNA配列も異なるにも関わらず,Sxl RBD1-RBD2とHuC RBD1-RBD2との間には1次配列に顕著な相同性が認められる.したがって,これら2つを比較することにより,これらに共通のRNA認識機構が明らかになると考えた. 1.Sxl RBD1の立体構造解析 一般的なRBDには,2つの保存配列RNP1(8アミノ酸残基),RNP2(6アミノ酸残基)があり,一般にこれらが シート面に提示されることでRNA結合を行うと考えられている.ところがSxl RBD2では,RNP1で一般にRNA結合に必要とされる3番目の芳香性残基が保存されず,Val133に置換している(図2).Sxl RBD1の場合はこの配列の保存性がさらに曖昧である.そこでNMR法によりSxl RBD1の立体構造解析を行い,Sxl RBD1上でのRNP1,RNP2に相当する残基を決定した.その結果,Sxl RBD1は一般のRBDと同じフォールディング( シート面に提示されることでRNA結合を行うと考えられている.ところがSxl RBD2では,RNP1で一般にRNA結合に必要とされる3番目の芳香性残基が保存されず,Val133に置換している(図2).Sxl RBD1の場合はこの配列の保存性がさらに曖昧である.そこでNMR法によりSxl RBD1の立体構造解析を行い,Sxl RBD1上でのRNP1,RNP2に相当する残基を決定した.その結果,Sxl RBD1は一般のRBDと同じフォールディング(      )をとりながら(図1), )をとりながら(図1), シート面上に一般のRBDとは異なる特徴的なアミノ酸配置を持つことが明らかとなった(図2).すなわちSxl RBD1では(1)RNP2上で一般にRNAとの結合に必要とされる2番目の位置の芳香族性残基がIle7に置換され,(2)RNP2上で一般には芳香族性残基の現れない5番目の位置にTyr10が現れ,(3)RNP1上で一般にRNAとの結合に必要とされる塩基性残基がPhe45に置換され,(4)2番目と3番目の シート面上に一般のRBDとは異なる特徴的なアミノ酸配置を持つことが明らかとなった(図2).すなわちSxl RBD1では(1)RNP2上で一般にRNAとの結合に必要とされる2番目の位置の芳香族性残基がIle7に置換され,(2)RNP2上で一般には芳香族性残基の現れない5番目の位置にTyr10が現れ,(3)RNP1上で一般にRNAとの結合に必要とされる塩基性残基がPhe45に置換され,(4)2番目と3番目の シートの間に,他のRBDでは滅多に現れない芳香族性残基が2つ(Tyr39,Tyr43)現れていることが明らかになった.さらに,Sxl RBD1は単独でRNA結合能を持つことより,一般のRBDとは異なるRNA認識機構でRNAを認識すると考えられる. シートの間に,他のRBDでは滅多に現れない芳香族性残基が2つ(Tyr39,Tyr43)現れていることが明らかになった.さらに,Sxl RBD1は単独でRNA結合能を持つことより,一般のRBDとは異なるRNA認識機構でRNAを認識すると考えられる.  図1 Sxl RBD1,RBD2およびHuC RBD1,RBD2の立体構造のリボンモデル本研究でNMR法によって決定されたSxl RBD1,HuC RBD1,RBD2,武藤らによって決定されたSxl RBD2の立体構造をリボンモデルで示す. 図1 Sxl RBD1,RBD2およびHuC RBD1,RBD2の立体構造のリボンモデル本研究でNMR法によって決定されたSxl RBD1,HuC RBD1,RBD2,武藤らによって決定されたSxl RBD2の立体構造をリボンモデルで示す.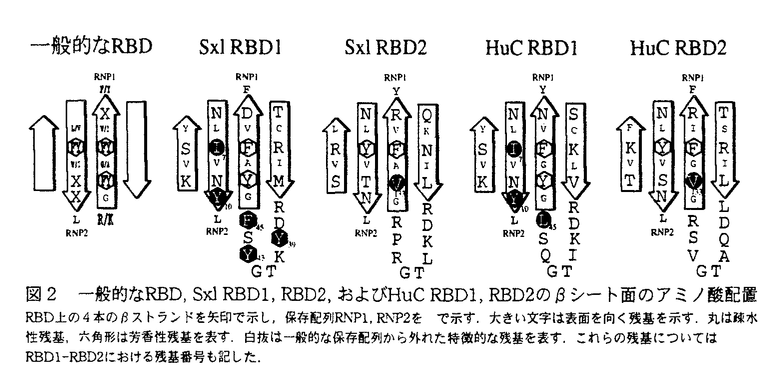 図2 一般的なRBD,Sxl RBD1,RBD2,およびHuC RBD1,RBD2の 図2 一般的なRBD,Sxl RBD1,RBD2,およびHuC RBD1,RBD2の シート面のアミノ酸配置RBD上の4本の シート面のアミノ酸配置RBD上の4本の ストランドを矢印で示し,保存配列RNP1,RNP2をで示す.大きい文字は表面を向く残基を示す.丸は疎水性残基,六角形は芳香性残基を表す.白抜は一般的な保存配列から外れた特徴的な残基を表す.これらの残基についてはRBD1-RBD2における残基番号も記した.2.HuC RBD1,RBD2の立体構造解析 ストランドを矢印で示し,保存配列RNP1,RNP2をで示す.大きい文字は表面を向く残基を示す.丸は疎水性残基,六角形は芳香性残基を表す.白抜は一般的な保存配列から外れた特徴的な残基を表す.これらの残基についてはRBD1-RBD2における残基番号も記した.2.HuC RBD1,RBD2の立体構造解析 Sxl RBD1,RBD2の シート面上に見いだされた特徴的なアミノ酸が,1次配列上類似しているHuC RBD1,RBD2にも見いだされるか否かを調べるために,NMR法によりHuC RBD1,RBD2の立体構造解析を行った.その結果,HuC RBD1,RBD2は立体構造上はともにSxl RBD1,RBD2と同じフォールディング( シート面上に見いだされた特徴的なアミノ酸が,1次配列上類似しているHuC RBD1,RBD2にも見いだされるか否かを調べるために,NMR法によりHuC RBD1,RBD2の立体構造解析を行った.その結果,HuC RBD1,RBD2は立体構造上はともにSxl RBD1,RBD2と同じフォールディング(      )を示した(図1).さらにそれらの )を示した(図1).さらにそれらの シート面のアミノ酸配置をSxl RBD1,RBD2の場合と比較したところ,HuC RBD1にはSxl RBD1にみられたのと同様のアミノ酸置換,すなわち(1)RNP2上の2番目の芳香性残基のIle7への置換,(2)RNP2上の5番目の位置におけるTyr10の出現,(3)RNP1の1番目の塩基性残基のLeu45への置換が認められた(図2).ただし,Sxl RBD1でみられた シート面のアミノ酸配置をSxl RBD1,RBD2の場合と比較したところ,HuC RBD1にはSxl RBD1にみられたのと同様のアミノ酸置換,すなわち(1)RNP2上の2番目の芳香性残基のIle7への置換,(2)RNP2上の5番目の位置におけるTyr10の出現,(3)RNP1の1番目の塩基性残基のLeu45への置換が認められた(図2).ただし,Sxl RBD1でみられた 2と 2と 3の間のループの2つの芳香性残基はHuC RBD1には認められなかった.また,HuC RBD2上では,一般に芳香性のアミノ酸が現れてRNAに寄与すると考えられているRNP1の3番目の位置がVal133に置換していたが,この特徴はSxl RBD2と共通する(図2).以上をまとめると,HuC RBD1とSxl RBD1同士,HuC RBD2とSxl RBD2同士がそれぞれ 3の間のループの2つの芳香性残基はHuC RBD1には認められなかった.また,HuC RBD2上では,一般に芳香性のアミノ酸が現れてRNAに寄与すると考えられているRNP1の3番目の位置がVal133に置換していたが,この特徴はSxl RBD2と共通する(図2).以上をまとめると,HuC RBD1とSxl RBD1同士,HuC RBD2とSxl RBD2同士がそれぞれ シート面に共通の特徴的なアミノ酸配置を持つこととなる.これより,HuC RBD1-RBD2とSxl RBD1-RBD2が共通のRNA認識機構でRNAを認識することが示唆された. シート面に共通の特徴的なアミノ酸配置を持つこととなる.これより,HuC RBD1-RBD2とSxl RBD1-RBD2が共通のRNA認識機構でRNAを認識することが示唆された. 3.HuC RBD1,RBD2,RBD1-RBD2のRNA結合能 2つのRBDがつながることによるRNA結合能への寄与を調べるために,HuC RBD1,RBD2,およびそれらがつながったRBD1-RBD2のRNA結合能を比較した.結合能測定にはNMR法を用い,RNA添加に伴うRBDの1H,15Nの化学シフト変化を測定した.その結果,HuC RBD1,RBD2それぞれが単独でRNA結合能を有し,化学シフト変化から推定した結合部位は主に シート面に位置した.ここには,先に述べたHuC RBD1,RBD2上の特徴的なアミノ酸も含まれる.このときの化学シフト変化は,RNAの濃度に依存して徐々に変化する,いわゆる「速い交換速度」の挙動を示したことから,HuC RBD1,RBD2それぞれ単独では短寿命(1 msec以下)の不安定なRBD/RNA複合体を形成することがわかった. シート面に位置した.ここには,先に述べたHuC RBD1,RBD2上の特徴的なアミノ酸も含まれる.このときの化学シフト変化は,RNAの濃度に依存して徐々に変化する,いわゆる「速い交換速度」の挙動を示したことから,HuC RBD1,RBD2それぞれ単独では短寿命(1 msec以下)の不安定なRBD/RNA複合体を形成することがわかった. 一方HuC RBD1-RBD2の場合もRBD1,RBD2単独の場合と同様 シート面に結合部位を示したが(図3),その化学シフト変化はいわゆる「遅い交換速度」の挙動を示した.これより,HuC RBD1-RBD2/RNA複合体は長寿命(100msec以上)の安定な複合体を形成していることが明らかとなった.このことは,それぞれではRNA結合能が弱いHuC RBD1,RBD2が,2つつながってRBD1-RBD2になることではじめて強い1本鎖RNA結合能を獲得することを示す. シート面に結合部位を示したが(図3),その化学シフト変化はいわゆる「遅い交換速度」の挙動を示した.これより,HuC RBD1-RBD2/RNA複合体は長寿命(100msec以上)の安定な複合体を形成していることが明らかとなった.このことは,それぞれではRNA結合能が弱いHuC RBD1,RBD2が,2つつながってRBD1-RBD2になることではじめて強い1本鎖RNA結合能を獲得することを示す.  図3 RNA結合に伴うHuC RBD1-RBD2の化学シフト変化RNA UAUUUAUUUUとの結合に伴うRBD1-RBD2上の主鎖のHN,Nの化学シフト変化を,HuC RBD1,RBD2の立体構造上に示す. 図3 RNA結合に伴うHuC RBD1-RBD2の化学シフト変化RNA UAUUUAUUUUとの結合に伴うRBD1-RBD2上の主鎖のHN,Nの化学シフト変化を,HuC RBD1,RBD2の立体構造上に示す. さらにHuC RBD1-RBD2/RNA複合体では,NOESYスペクトルを測定した.その結果,HuC RBD1-RBD2とRNAとの間に,主にRBD側の疎水性残基に由来する多数の分子間NOEが観測された.この残基のうちのいくつかは,先に述べた特徴的なアミノ酸であるRBD1上のIle7,Leu45,RBD2上のVal133に由来すると推定される.以上述べた特徴はSxl RBD1-RBD2の場合にも見いだされていることから(金,武藤ら;私信),HuC RBD1-RBD2とSxl RBD1-RBD2は,原子レベルで共通のRNA認識機構を持つと考えられる. 考察 以上の結果に基づき,Sxl RBD1-RBD2,HuC RBD1-RBD2でRBDがつながって存在する意義を考察する.HuC RBD1-RBD2は,それぞれでは結合能の弱いRBD1,RBD2がつながることにより,はじめて強いRNA結合能を示したが,このことは,1個のRBDでは識別できない長い結合RNA配列と特異的に結合する上で合目的である.すなわちRBD1,RBD2の一方がある結合RNA配列の候補と結合したとき,そこが目標のRNA配列でない場合は残りのRBDはRNAと結合することができないため,すばやくRNAから離れて他の結合RNA配列の候補の探索に移行し,その繰り返しにより目的の結合RNA配列にたどり着くことができる.また,今回Sxl RBD1-RBD2とHuC RBD1-RBD2に共通に見いだした特徴的なアミノ酸残基の配置は,RBD1-RBD2が結合RNA配列とより強く結合するために新たに獲得した特徴と推定される.まとめると,タンデムにつながる2つのRBDが1つの機能単位として共進化したことで,より高いRNA結合配列特異性を獲得した,と表現できる.他の複数個のRBDを持つタンパク質でも,高いRNA結合配列特異性を要求される場合には,このような複数のRBD間の共進化が起きていると予想する. |
| 審査要旨 | | RNA結合ドメイン(RBD)は,特定の1本鎖RNAと特異的に結合することにより,RNAの代謝制御を行うと考えられているドメインである.これまでに真核生物において,RBDを有するタンパク質が数多く同定されていることから,RBDは,RNA代謝系において中心的な役割を果たすドメインの1つと考えられている. 本論文では,Sex-lethalタンパク質のN末端側のRBD(Sxl RBD1),およびHuCタンパク質のN末端側の2個のRBD(HuC RBD1,RBD2)のNMR法による解析を通じて,これまで未知であった複数個のRBDによる1本鎖RNAの特異的認識機構を,立体構造の立場から明らかにしている. 第2章では,NMR法によるSxl RBD1の立体構造を行っている.Sxl RBD1は,そのドメイン境界の曖昧さ,および溶解度の低さからこれまで立体構造解析は困難とされてきたものである.しかし本研究で,プロテアーゼ処理によりドメイン境界を同定し,溶解度を高める部位特異的変異と測定条件を見出したことにより,立体構造解析を達成している.その結果,Sxl RBD1上の シート面に,一般的な保存配列から外れる特徴的なアミノ酸残基Ile7,Tyr10,Phe45を見出した. シート面に,一般的な保存配列から外れる特徴的なアミノ酸残基Ile7,Tyr10,Phe45を見出した. 第3章では,NMR法により,HuC RBD1,RBD2の立体構造解析を行い,Sxl RBD1,RBD2との立体構造上の比較を行っている.立体構造解析の結果,HuC RBD1,RBD2とも,これまで知られているRBDと同じフォールディングであったが,それらの シート面のアミノ酸配置の比較により,特にHuC RBD1上に,Sxl RBD1と酷似する特徴的なアミノ酸残基Ile7,Tyr10,Leu45を見出し,HuC RBD1とSxl RBD1の立体構造上の類似性を明らかにしている. シート面のアミノ酸配置の比較により,特にHuC RBD1上に,Sxl RBD1と酷似する特徴的なアミノ酸残基Ile7,Tyr10,Leu45を見出し,HuC RBD1とSxl RBD1の立体構造上の類似性を明らかにしている. 第4章では,NMR法により,HuC RBD1,RBD2,およびそれらがつながったRBD1-RBD2のRNA結合能解析を行っている.その結果,RBD1-RBD2におけるRBD1,RBD2間の協働的な1本鎖RNA結合能を見出し,RBD1とRBD2がつながって存在することの重要性を明らかにしている.さらに,RBD1-RBD2の結合RNA配列をAUUUAUUUUと決定しており,これにより,第5章における複合体の立体構造解析を可能にしている. 第5章では,NMR法により,HuC RBD1-RBD2/RNA複合体の立体構造解析を行い,2個のRBDによる1本鎖RNAの認識機構を原子レベルで解明している.NMRでは,これまでこのような1本鎖RNAとタンパク質との,分子量2万を越える大きな複合体の立体構造解析の例はない.したがって,その水溶液中での1本鎖RNAの認識機構を原子レベルで明らかにした点は特筆すべき成果である.HuC RBD1-RBD2は立体構造上,RNAを2つのRBDで挟み込む形で認識することを明らかにし,この認識機構に第2,3章で指摘した特徴的なアミノ酸残基が重要な役割を果たしていることを示している.その結果,第4章で示した2つのドメイン間での協働的なRNA認識機構を,立体構造の立場から解明するに至っている.さらに,最近半田らによって明らかになったSxl RBD1-RBD2とRNAの複合体のX線結晶構造解析の結果との比較により,HuC RBD1-RBD2とSxl RBD1-RBD2との共通点,相違点を明らかにしている. 最終章では,HuC RBD1-RBD2の1本鎖RNA認識機構を踏まえ,複数個のRBDによる一般的な1本鎖RNA認識機構,HuCとSxlの進化上の関係,HuCの生物学的機能との関係を議論し,RBDをとりまく今後の課題を提起している. 以上の研究において,すべてのRBD,RNAの調製,NMR測定,シグナルの帰属,データの解析,立体構造決定は,論文提出者が主体となって行われたものであり,審査委員会は本論文提出者が博士(理学)の学位を受ける資格があるものと判定した.なお,本論文第2章は東京大学の横山茂之教授,武藤裕博士,木川隆則博士(現理化学研究所),京都大学の志村令郎教授(現生物分子工学研究所),坂本博博士(現神戸大学),理化学研究所の瀧尾擴士博士との共同研究であり,第3章以降は東京大学の横山茂之教授,武藤裕博士,神戸大学の坂本博博士との共同研究であるが,いずれも論文提出者が主体となって分析,および検証を行ったもので,論文提出者の寄与が十分であると判断する.したがって,博士(理学)の学位を授与できると認める. |