本論文において、論文提出者は、自己免疫疾患の発症機構について解析を行っている。本論文は2章からなり、第1章では、関節浸潤T細胞の標的抗原について、第2章では、このマウスにおける自己免疫発症機構について述べられている。 慢性関節炎は、多発性、進行性の自己免疫疾患であり、その病態形成には遺伝要因・環境要因が複雑に絡み合って、炎症反応を誘導していると考えられているが、その発症機構は詳細には明らかになっていない。論文提出者は、自己免疫性の慢性関節炎を自然発症するヒトT細胞白血病ウイルス(HTLV-I)遺伝子中のenv-pX領域を導入したトランスジェニックマウス(pXマウス)をモデルとして、慢性関節炎の発症機構について検討した。 pXマウスは、4週令ごろからヒトの慢性関節リウマチに類似した慢性関節炎を多発する。トランスジェニックマウスの骨髄細胞を移入することによって野生型マウスに関節炎を誘導できることから、このマウスが発症する関節炎は免疫系の異常に起因していることが示唆されている。また、ヌードマウスと掛け合わせると発症率が著しく低下することから、この関節炎病態形成にはT細胞が関与していると考えられる。そこで、論文提出者は、HTLV-IによるT細胞の機能異常に着目し、解析を行った。 まず、慢性関節炎を発症している個体の関節局所において、オリゴクローナルなT細胞クローンの集積を見いだし、これらのT細胞が特異的抗原を認識していることを明らかにした。さらに、関節に集積しているT細胞の標的抗原を同定する目的で、同一マウスのリンパ節細胞を、種々の抗原と共に培養した結果、II型コラーゲンと培養した場合に、関節で集積しているT細胞と同一のT細胞クローンが増殖することが分かった。以上の結果から、II型コラーゲンがその標的抗原のひとつであり、II型コラーゲンに対する異常反応性がpXマウスが発症する慢性関節炎の原因であることを示唆した。 pXマウスにおいては、内在性のスーパー抗原に反応するV をもつT細胞は、野生型と同じく、末梢において消失していることなどから、胸腺におけるネガティブセレクションは正常であると考えられ、これらの自己反応性T細胞の出現機構として、末梢の自己免疫寛容の破綻が示唆された。末梢の自己免疫寛容誘導機構として、アポトーシスによるクローン除去と、副シグナルの欠如による免疫不応答の誘導があげられる。pXマウスのリンパ節細胞は、抗Fas抗体によって誘導されるアポトーシスに対して抵抗性であることがすでに示されているが、副シグナルの異常の可能性については、まだ検討されていなかった。そこで、論文提出者はpXマウスにおけるCD28下流のシグナルについて検討を行った。 をもつT細胞は、野生型と同じく、末梢において消失していることなどから、胸腺におけるネガティブセレクションは正常であると考えられ、これらの自己反応性T細胞の出現機構として、末梢の自己免疫寛容の破綻が示唆された。末梢の自己免疫寛容誘導機構として、アポトーシスによるクローン除去と、副シグナルの欠如による免疫不応答の誘導があげられる。pXマウスのリンパ節細胞は、抗Fas抗体によって誘導されるアポトーシスに対して抵抗性であることがすでに示されているが、副シグナルの異常の可能性については、まだ検討されていなかった。そこで、論文提出者はpXマウスにおけるCD28下流のシグナルについて検討を行った。 pXマウスのリンパ節細胞を抗原と共に培養した結果、野生型マウスに比べ、高い細胞増殖が観察された。さらにこのとき、CTLA-4Igによって副シグナルを阻害しても、pXマウスのリンパ節細胞においては、野生型と異なり、増殖の抑制が見られなかったことから、pXマウスのリンパ節細胞では、副シグナルが恒常的に活性化している可能性を示唆した。さらに、CD28下流分子であるSAPK/JNKの活性化を調べ、SAPK/JNKが活性化が過剰に活性化していることを示した。 また、胸腺におけるネガティブセレクションには、CD28のシグナルが関与していることが示唆されているが、pXマウスは、野生型マウスに比べて、抗原刺激を加えたとき、胸腺細胞のアポトーシスが異常に亢進することを示した。この結果から論文提出者は、胸腺細胞でもCD28下流のシグナル伝達系が活性化しており、その結果、TCR刺激に対して高感受性になり、アポトーシスが亢進している可能性を示唆している。 以上の結果から論文提出者は、pXマウスのT細胞において、CD28下流のシグナルが恒常的に活性化されており、末梢性のT細胞免疫寛容が破綻していることが、pXマウスの自己免疫疾患発症の原因のひとつであることを示唆している。副シグナルの活性化機構として、論文提出者は、CD28の下流の分子であるMEKK-1がHTLV-Iによって活性化されているために、CD28の下流のシグナルが活性化されている可能性、あるいは、SAPK/JNKはIL-1やTNF-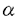 の刺激によっても活性化されることから、HTLV-Iによって誘導されたこれらの炎症性サイトカインによって、副シグナルが活性化されている可能性を指摘している。ヒトの関節リウマチ患者においても、IL-1やTNF- の刺激によっても活性化されることから、HTLV-Iによって誘導されたこれらの炎症性サイトカインによって、副シグナルが活性化されている可能性を指摘している。ヒトの関節リウマチ患者においても、IL-1やTNF-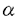 の産生亢進が認められることから、ヒトにおいても、SAPK/JNKの活性化による副シグナルの活性化が自己免疫の発症の原因となっている可能性が考えられ、非常に興味深い。 の産生亢進が認められることから、ヒトにおいても、SAPK/JNKの活性化による副シグナルの活性化が自己免疫の発症の原因となっている可能性が考えられ、非常に興味深い。 なお、本論文第1章は、田川陽一氏、岩倉洋一郎氏との共同研究であるが、論文提出者が主体となって分析及び検証を行ったもので、論文提出者の寄与が十分であると判断する。 本論文より得られた成果は、非常に独創的であり、今後の免疫学の発展に大きく寄与すると考える。したがって、博士(理学)の学位を授与できると認める。 |