低分子量GTP結合タンパク質Rasは細胞内情報伝達系において、細胞の増殖や分化に重要な役割を果たしている。Ser/thr kinase Raf-1はこのRasの直接のターゲットである。本論文ではRaf-1のRas結合ドメイン(Raf-1 RBD)とRasの相互作用をNMRと分子動力学法を用いて明らかにしている。 本論文は6章からなる。第1章ではRas、Raf-1、およびRasのホモログであるRap1Aについて導入を行っている。 第2章では、多核多次元NMRを用いたRaf-1RBD単体の構造決定について述べている。ここでは、Raf-1RBDが1つの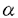 -helix、5つの -helix、5つの -strand、および1つの短いhelixからなり、ubiquitineと類似の折りたたみ構造をとっていることを明らかにしている。 -strand、および1つの短いhelixからなり、ubiquitineと類似の折りたたみ構造をとっていることを明らかにしている。 第3章では、Raf-1RBDとRasとの相互作用のNMR解析について述べている。Raf-1RBDとRasの複合体の分子量は30kDa余りで、従来の方法で構造解析が可能な分子量の上限(約20kDa)を大きく超える。そこで、本研究ではRaf-1RBDを重水素標識することで、磁化の減衰を抑えNMRスペクトルの感度の向上を図っている。ここでは2H/13C/15N3重標識されたRaf-1RBD単体および非標識Rasとの複合体についてRaf-1RBDの主鎖核(1HN、15N、 、13CO)の共鳴を帰属し、Ras結合に伴うRaf-1RBDの主鎖の化学シフトの変化を求めている。この結果、 、13CO)の共鳴を帰属し、Ras結合に伴うRaf-1RBDの主鎖の化学シフトの変化を求めている。この結果、 1、 1、 2および 2および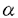 1上の残基で化学シフトが大きく変化していることが明らかになった。 1上の残基で化学シフトが大きく変化していることが明らかになった。 第4章では、Raf-1RBDとRas(D30E/E31K)変異体との相互作用のNMR解析について述べている。ここでは非標識のRas(D30E/E31K)変異体との複合体について2H/13C/15N3重標識されたRaf-1RBDについて主鎖の共鳴を比較している。これを、第3章のRas野生型との複合体におけるRaf-1RBDの主鎖の化学シフトと比較した結果、Rasに導入したD30E/E31K変異は、Raf-1RBDの主鎖の化学シフトにほとんど影響を与えないことが明らかになった。別の研究グループからRasのホモログRap1AのRas型変異体E30D/K31EとRaf-1RBDとの複合体では、Rap1AのGlu31がRaf-1RBDのLys84と強いsalt bridgeを形成していることが示されているが、この研究の結果、Rasとの複合体においてはこのsalt bridgeが形成されていないことが示唆された。 第5章ではRaf-1RBD・Ras複合体のモデルの作成と、分子動力学シミュレーションによる解析について述べている。ここでは、Raf-1RBDとRap1AのRas型変異体E30D/K31Eとの複合体の結晶構造およびGTP結合型Rasの結晶構造を用いて、立体構造上の相同性に基づき、Raf-1RBD・Ras複合体のモデルを作成している。次いでこの初期モデル構造を精密化するために水溶液中の条件で1800psの分子動力学シミュレーションを行っている。また、対照のためにRaf-1RBDとRap1A(E30D/K31E)との複合体の結晶構造から出発した分子動力学シミュレーションも行っている。シミュレーションで得られた構造を解析した結果、Rap1Aとの複合体においては、もともと結晶構造で指摘されていた通り、Raf-1RBDのLys84はRap1AのGlu31と強いsalt bridgeを形成していることが確認されたが、Rasとの複合体においては、Raf-1RBDのLys84とRasのGlu31の間の相互作用は非常に弱く、代わりにRasのAsp33と強いsalt bridgeを形成していることが明らかになった。この結果、Raf-1RBD・Ras複合体の相互作用メカニズムはRaf-1RBD・Rap1A(E30D/K31E)複合体とは異なっていることが示唆された。これは第4章のNMR解析の結果と一致している。 第6章では、NMRおよび分子動力学法で得られたRaf-1RBDとRasの相互作用モデルを、Ras変異体を用いた生化学的な解析データと比較し、これらが一致していることを示している。また、RasとRap1AにおけるGlu31の役割およびGDP-GTP交換に伴うRasのRaf-1RBDに対する結合活性変化のメカニズムについても考察している。 なお、本論文は理化学研究所の伊藤 隆研究員、白水美香子研究員、舘野 賢研究員(現工業技術院生命工学技術研究所)、橋本恭子氏、木川孝則研究員、戎崎俊一主任研究員、瀧尾擴士室長、柴田武彦主任研究員、東京大学の横山茂之教授、英国ケンブリッジ大学のBrian O.Smith博士(現エジンバラ大学)、Ernest D.Laue博士、および米国フレッドハッチンソンガン研究センターのJonathan A.Cooper博士との共同研究であるが、NMR測定に用いたすべてのタンパク質サンプルの調整、NMR測定、NMRスペクトルの解析、構造計算、分子動力学シミュレーションおよびその解析は、論文提出者が主体となって行っており、本研究に対する論文提出者の寄与は十分であると判断する。 従って、博士(理学)の学位を授与できると認める。 |