| 内容要旨 | | 植物の地上部は、葉、茎とこれらを分化するシュート頂分裂組織から構成されている。中でも葉は、多様な形態を示すほか、光合成などを遂行する基本器官であり、植物の形態形成の機構を知る上で、最も重要な要素である。しかし、その形態構築の過程は、細胞の分裂と伸長とを、同時的かつ非局在的に伴う複雑な系であるため(Poethig and Sussex,1985)、従来の解剖学的な研究のみからでは、その発生過程の理解は不十分であった。これを打開するためには、遺伝学的な手法を導入することが有効と考えられる。 私が博士課程において研究を進めた研究室ではこれまで、モデル植物としてアラビドプシス(Arabidopsis thaliana(L.)Heynh.)を用い、発生遺伝学的解析により、葉の形態が極性伸長を通して遺伝的に支配されていることを明らかにしてきた(Tsuge et al.1996)。そこで本研究はこれをさらに発展させ、特に葉の長軸方向への伸長制御に注目し、その分子メカニズムを解明することを目標とした。そのため、まず葉の長軸方向への細胞極性伸長に欠損を示すrot3-1とアレリックな変異体を新たに単離し、さらに詳細な解析を進めると共に、ROT3遺伝子のクローニングを試みた。その結果、葉細胞の極性伸長を司る遺伝子を世界で初めて単離すると共に、その機能を明らかにした(Kim et al.1998)。 結果と考察1)新たなrotundifolia3アリルの単離 まず、葉形態形成におけるROT3遺伝子の機能をさらに詳しく調べるため、葉の長軸方向への細胞極性伸長に欠損を示すrot3-1とアレリックな変異体を、様々な変異原処理系統から単離した。その結果、EMS処理よりrot3-2アリルを、また約22,000のT-DNA挿入株よりrot3-3アリルを得た(図1)。単離したいずれのアリルも胚軸、根は正常で、短い葉柄と丸い葉といった共通の表現型を示した(図1、2K、表1)。ただしrot3-2アリルのみは共通の表現型の他、葉身が大型化し茎が太くなるという、他のアリルで見られない特徴的な表現型を示した(図1、2、表1)。そこでrot3-2アリルについて、さらに解剖学的解析を行なった結果、葉身の表現型は葉身の細胞数の変化ではなく、細胞の伸長促進によることが確認された(図2、表2、3)。また、茎の細胞においても葉と同様な結果が認められた(図2G,H)。以上の結果からrot3-2アリルは、若干性質が異なるものの、rot3-1と同様、細胞伸長の制御に関わる変異体であると考えられた。 2)ROT3遺伝子の単離 一方、T-DNA挿入による変異体rot3-3を出発材料として、タギング法により当該遺伝子の単離を試みた。まず、プラスミド・レスキュー法によりT-DNAright border近傍の1.2kbフラグメントを単離した(図3A)。単離したフラグメントを用い、表現型とT-DNAの挿入部位との連鎖を調べた結果、rot3変異とT-DNA挿入が0.0±0.5cM以内に連鎖していることが確認された。また、単離した1.2kbフラグメントをプローブとして用いサザンブロット解析を行なったところ、速中性子線処理に由来するrot3-1変異ではゲノム領域の欠失が(図3B)、rot3-3変異ではプロモーター領域へのT-DNA挿入が認められた(図3A)。また、poly(A)+RNAを用いてノーザン解析を行なった結果、野生株において約1.8kbの転写産物が検出された(図3C)。そこでこれをコードするcDNAをクローニングし、プローブとしてサザンブロット解析を行なったところ、この遺伝子はゲノム中single copyで存在することが示唆された(図4)。 3)ROT3遺伝子の分子生物学的解析 塩基配列の分析を行なった結果、ROT3遺伝子は524アミノ酸からなるチトクロムP450ファミリーの1つ、CYP90C1をコードすることが判明した(図5)。また、ROT3遺伝子は9つのexonを持つこと(図3A)、4番染色体のAP2座位とリンクしていることが判明した。CYP90C1は、brassinosteroid合成に関与しているCPD遺伝子の翻訳産物・CYP90A1と最も高い相同性を示した他、同じくbrassinosteroid合成系に関与すると推定されるトマト由来DWARF遺伝子の翻訳産物・CYP85や、gibberellin合成に関与しているトウモロコシのCYP88とも高い相同性を示した(図5)。またCYP90C1は、ステロイド合成系に関与するP450において基質認識サイトとして保存されているSRSドメインも保持している(図5B)ことから、CYP90C1はステロイド合成系に関与している可能性が考えられる。しかし、brassinosteroid及び既知の植物ホルモンの処理では、rot3変異の表現型がレスキューできなかった。また、brassinosteroid関連の変異体は全て暗所での光形態形成に異常を示すことが知られているが、rot3変異体は正常な暗所形態形成を示した(図6)。このことから、ROT3遺伝子が直接brassinosteroid合成に関与している可能性は低いと考えられた。 4)rot3アリルの分子遺伝学的解析 ROT3遺伝子の機能と形態形成制御との関連を知る目的から、変異体ごとに転写レベルでの確認を行なった。その結果、速中性子線処理に由来するrot3-1変異では発現が検出されず、EMS処理で得られたrot3-2変異では野生型と同程度の発現が、またT-DNAタグに由来するrot3-3変異では低いレベルの発現が認められた(図7A)。そこで各アリルについて、ROT3遺伝子上の変異部位の確認を行なったところ、EMS処理で得られたrot3-2変異ではproline-richドメインにおける80番目のGlyがGluに置換されていることが判明した(図5B)。このproline-richドメインは全てのP450で保存されており、基質との結合に重要な役割をしていることが知られている。このことから、rot3-2変異による表現型の変化は、アミノ酸の置換によって、本来のROT3の機能が変化したためであると考えられた。したがって、ROT3遺伝子の本来の機能対象は、null変異であるrot3-1,rot3-3が示すように、葉に特異的であると考えられる。また組織ごとのmRNA発現パターンを調べた結果、ROT3遺伝子は植物体の全組織で発現していることが判明した(図7B)。特に細胞分裂が活発に行われている組織において、比較的強い発現が見られることから、ROT3遺伝子は細胞分裂期に発現され、細胞伸長部位に間接的に影響を与えている可能性も考えられる。 5)相補性テストとトランスジェニック植物の過剰発現による形態変化の解析 誘導性プロモーターの制御下に、ROT3遺伝子とrot3-2変異型遺伝子とを、null変異体であるrot3-1変異体に発現させたトランスジェニック植物を作成し、相補性テストと共に過剰発現による形態変化の解析を行なった。その結果、ROT3遺伝子の過剰発現を行なうことで葉身と葉柄の長さの増大が認められた(図8、9)。特に3コピー分がゲノムに挿入された株では、野生型やrot3変異体と異なり、葉の先端が尖るなどの表現型が認められた(図8A)。また花弁においても極性伸長の変化が認められた(図8B)。また、rot3-2変異型遺伝子を発現させたトランスジェニック植物は、rot3-2変異体と同様な表現型を示すことが認められた(図8A)。さらに、細胞レベルでの変化を調べるため、解剖学的な解析を行なった。その結果、葉の長軸方向への細胞の極性伸長の増大が確認された。以上の結果より、ROT3遺伝子は葉細胞の極性伸長制御の鍵となる遺伝子であることが再確認できた。 結論 1)葉の極性伸長を司るROT3遺伝子に関し、その機能を詳しく調べるため、rot3-1変異体とアレリックな変異体を新たに単離し、解剖学的な解析を行なった。 2)T-DNAタギング法を用い、ROT3遺伝子のクローニングを行なった結果、ROT3遺伝子はチトクロムP450ファミリーの1つ、CYP90C1をコードすることが判明した。 3)葉身と茎において細胞伸長が増大するという特徴的な表現型を示すrot3-2変異では、proline-richドメインにおける80番目のGlyがGluに置換されていることが判明した。 4)ROT3遺伝子が葉細胞の極性伸長を支配する重要な遺伝子であることを、以上の変異体の遺伝学的解析と相補性テスト、及びトランスジェニック植物における過剰発現による系で確認した。 以上のように本研究では、葉細胞の極性伸長を司る遺伝子を世界で初めて単離すると共に、その機能を明らかにした。今後ROT3遺伝子のプロモータ領域の解析や、ROT3遺伝子の翻訳産物を用いた生化学的解析を通し、葉の伸長制御におけるより正確なROT3遺伝子の役割を、また葉の伸長制御の分子メカニズムを明らかにできると期待している。  図1アラピドプシスの野生株およびrot3変異体の〓種後.4週間目の形態.(A)野生株,(B)rot3-1,(C)rot3-2,(D)rot3-3,(E-G)rot3アリル同士のF1幽体,(E)rot3-1〓rot3-2,(F)rot3-1〓rot3-3,(G)rot3-2〓rot3-3.バーは10mm 図1アラピドプシスの野生株およびrot3変異体の〓種後.4週間目の形態.(A)野生株,(B)rot3-1,(C)rot3-2,(D)rot3-3,(E-G)rot3アリル同士のF1幽体,(E)rot3-1〓rot3-2,(F)rot3-1〓rot3-3,(G)rot3-2〓rot3-3.バーは10mm 表1rot3-2変異体の各器官における表現型 表1rot3-2変異体の各器官における表現型 表2野生株およびrot3-2変異体の葉身及び葉柄における細胞の形態比較 表2野生株およびrot3-2変異体の葉身及び葉柄における細胞の形態比較 表3野生株およびrot3-2変異体の展開葉における細胞数の比較 表3野生株およびrot3-2変異体の展開葉における細胞数の比較 図2rot3-2アリルの表現型,(A,B)野生株(A),rot3-2(B)の葉発生順に並べて示す.バーは10mm.(C,D)野生株(C),rot3-2(D)の葉の横断切片像,バーは100 図2rot3-2アリルの表現型,(A,B)野生株(A),rot3-2(B)の葉発生順に並べて示す.バーは10mm.(C,D)野生株(C),rot3-2(D)の葉の横断切片像,バーは100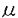 m.(E,F)野生株(E),rot3-2(F)の葉の表皮細胞,バーは100 m.(E,F)野生株(E),rot3-2(F)の葉の表皮細胞,バーは100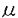 m.(G,H)野生株(G),rot3-2(H)の茎の横断切片像,(I,J)野生株(I),rot3-2(J)の茎の縦断切片像,バーは200 m.(G,H)野生株(G),rot3-2(H)の茎の横断切片像,(I,J)野生株(I),rot3-2(J)の茎の縦断切片像,バーは200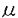 m.(K)野生株およびrot3-2の根の生長曲線 m.(K)野生株およびrot3-2の根の生長曲線 図3ROT3遺伝子座位近傍の物理マップとROT3遺伝子の発現解析,(A)rot3-2変異体におけるT-DNA挿入部位近傍のマップを示す.矢印はROT3のプロモーター領域を,黒いbu〓はROT3遺伝子の9胴のexon領域を示す.(B)野生株及びrot3変異体におけるサザンブロット解析.プローブD(A)を用いたサザン解析より,rot3-1変異ではROT3座位領域の欠失が判明した.(C)B断片(A)をプローブとしたノーザン解析,約1.2kbの転写産物を示す. 図3ROT3遺伝子座位近傍の物理マップとROT3遺伝子の発現解析,(A)rot3-2変異体におけるT-DNA挿入部位近傍のマップを示す.矢印はROT3のプロモーター領域を,黒いbu〓はROT3遺伝子の9胴のexon領域を示す.(B)野生株及びrot3変異体におけるサザンブロット解析.プローブD(A)を用いたサザン解析より,rot3-1変異ではROT3座位領域の欠失が判明した.(C)B断片(A)をプローブとしたノーザン解析,約1.2kbの転写産物を示す. 図4アラビドプシスゲノム中におけるROT3遺伝子及びその関連配列のサザンブロット解析cDNAの全長をプローブとして,high-stringency条件(A),及びlow-stringency条件(B)でハイブリダイゼーションした。矢印は(B)でのみ見られるバンドを示す. 図4アラビドプシスゲノム中におけるROT3遺伝子及びその関連配列のサザンブロット解析cDNAの全長をプローブとして,high-stringency条件(A),及びlow-stringency条件(B)でハイブリダイゼーションした。矢印は(B)でのみ見られるバンドを示す. 図5ROT遺伝子の翻訳産物・CYP90C1と他の類似チトクロムP450とのアミノ酸配列の比較.(A)アミノ酸配列をもとに合成した系統樹下段のバーはCYP90C1との相同性(%)を示す.(B)アミノ酸配列に基づくアライメント.ステロイド合成品に関与するP450において基質認識サイトとして保存されるSRSドメインを図中に示す.上段の位置を示す.CYP90A1:アラビトプシス由来CPD遺伝子翻訳産物,CYP85:トマト由来DWARF遺伝子翻訳産物 図5ROT遺伝子の翻訳産物・CYP90C1と他の類似チトクロムP450とのアミノ酸配列の比較.(A)アミノ酸配列をもとに合成した系統樹下段のバーはCYP90C1との相同性(%)を示す.(B)アミノ酸配列に基づくアライメント.ステロイド合成品に関与するP450において基質認識サイトとして保存されるSRSドメインを図中に示す.上段の位置を示す.CYP90A1:アラビトプシス由来CPD遺伝子翻訳産物,CYP85:トマト由来DWARF遺伝子翻訳産物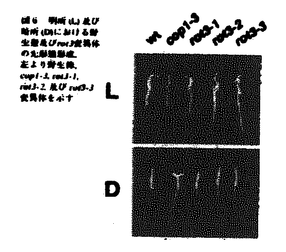 図6明所(L)及び暗所(D)における野生型及びrot3変異体の光形態形成,左より野生株,cop1-3,rot3-1,rot3-2及びrot3-3変異体を示す. 図6明所(L)及び暗所(D)における野生型及びrot3変異体の光形態形成,左より野生株,cop1-3,rot3-1,rot3-2及びrot3-3変異体を示す. 図7RT-PCR法によるROT3mRNAの蓄積〓の検出,全RNAを用いRT-PCRで増幅後,12pしたcDNAをプローブとし,サザンブロット解析を行った(A)野生株と各rot3アリルにおける発現〓の比較(B)ROT3mRNAのアラビドプシス野生株各器官における発現.左から,培養細胞,7日目の芽生え,根,子葉,ロゼット柄,茎,及び花での発現を示す.下段はコントロールとしてのTUB4遺伝子の発現〓. 図7RT-PCR法によるROT3mRNAの蓄積〓の検出,全RNAを用いRT-PCRで増幅後,12pしたcDNAをプローブとし,サザンブロット解析を行った(A)野生株と各rot3アリルにおける発現〓の比較(B)ROT3mRNAのアラビドプシス野生株各器官における発現.左から,培養細胞,7日目の芽生え,根,子葉,ロゼット柄,茎,及び花での発現を示す.下段はコントロールとしてのTUB4遺伝子の発現〓. 図8ROT3遺伝子を導入したトランスジェニック植物の表現型.(A)第1本葉(上段)及び第5本葉(下段)の形態.左から,野生株,rot3-1,rot3-2変異体,ROT3野生型遺伝子をrot3-1変異体に導入したトランスジェニック植物5系統(A2-1,S2-2,A2-3,A2-4,A4-1)及びrot3-2変異型遺伝子を導入したトランスジェニック植物(G80E).(B)野生株,トランスジェニック植物の花の形態. 図8ROT3遺伝子を導入したトランスジェニック植物の表現型.(A)第1本葉(上段)及び第5本葉(下段)の形態.左から,野生株,rot3-1,rot3-2変異体,ROT3野生型遺伝子をrot3-1変異体に導入したトランスジェニック植物5系統(A2-1,S2-2,A2-3,A2-4,A4-1)及びrot3-2変異型遺伝子を導入したトランスジェニック植物(G80E).(B)野生株,トランスジェニック植物の花の形態. 図9ROT3遺伝子導入による葉形態の変化.第5本葉の葉身の幅(A),長さ(B),及び葉柄の長さ(C)を示す.左より,野生株,rot3-1,ROT3野生型遺伝子を導入したトランスジェニック植物3系統(A2-1,A2-3,A2-4)及びrot3-2変異型遺伝子を導入したトランスジェニック植物を示す. 図9ROT3遺伝子導入による葉形態の変化.第5本葉の葉身の幅(A),長さ(B),及び葉柄の長さ(C)を示す.左より,野生株,rot3-1,ROT3野生型遺伝子を導入したトランスジェニック植物3系統(A2-1,A2-3,A2-4)及びrot3-2変異型遺伝子を導入したトランスジェニック植物を示す. |
| 審査要旨 | | 本論文では、モデル植物としてアラビドプシスを用い、葉の形態形成におけるが極性伸長の機構を発生遺伝学的解析により明らかにした。特に葉の長軸方向への伸長制御に注目し、その分子メカニズムを解明することを目標とし、まず葉の長軸方向への細胞極性伸長に欠損を示すrot3-1とアレリックな変異体を新たに単離し、さらに詳細な解析を進めると共に、ROT3遺伝子のクローニングを試みた。その結果、葉細胞の極性伸長を司る遺伝子を世界で初めて単離すると共に、その機能を明らかにした。 第一章ではまず、葉形態形成におけるROT3遺伝子の機能をさらに詳しく調べるため、葉の長軸方向への細胞極性伸長に欠損を示すrot3-1とアレリックな変異体を、様々な変異原処理系統から単離した。その結果、EMS処理よりrot3-2アリルを、また約22,000のT-DNA挿入株よりrot3-3アリルを得た。単離したいずれのアリルも胚軸、根は正常で、短い葉柄と丸い葉といった共通の表現型を示した。ただしrot3-2アリルのみは共通の表現型の他、葉身が大型化し茎が太くなるという、他のアリルで見られない特徴的な表現型を示した。そこでrot3-2アリルについて、さらに解剖学的解析を行なった結果、葉身の表現型は葉身の細胞数の変化ではなく、細胞の伸長促進によることが確認された。また、茎の細胞においても葉と同様な結果が認められた。以上の結果からrot3-2アリルは、若干性質が異なるものの、rot3-1と同様、細胞伸長の制御に関わる変異体であると考えられた。 一方、T-DNA挿入による変異体rot3-3を出発材料として、タギング法により当該遺伝子の単離を試みた。まず、プラスミド・レスキュー法によりT-DNA right border近傍の1.2kbフラグメントを単離した。単離したフラグメントをプローブとして用いサザンブロット解析を行なったところ、速中性子線処理に由来するrot3-1変異ではゲノム領域の欠失が、rot3-3変異ではプロモーター領域へのT-DNA挿入が認められた。そこでこれをコードするcDNAをクローニングし、プローブとしてサザンブロット解析を行なったところ、この遺伝子はゲノム中single copyで存在することが示唆された。 塩基配列の分析を行なった結果、ROT3遺伝子は524アミノ酸からなるチトクロムP450ファミリーの1つ、CYP90C1をコードすることが判明した。CYP90C1は、brassinosteroid合成に関与しているCPD遺伝子の翻訳産物・CYP90A1と最も高い相同性を示した他、同じくbrassinosteroid合成系に関与すると推定されるトマト由来DWARF遺伝子の翻訳産物・CYP85や、gibberellin合成に関与しているトウモロコシのCYP88とも高い相同性を示した。またCYP90C1は、ステロイド合成系に関与するP450において基質認識サイトとして保存されているSRSドメインも保持していることから、CYP90C1はステロイド合成系に関与している可能性が考えられる。しかし、brassinosteroid及び既知の植物ホルモンの処理では、rot3変異の表現型がレスキューできなかった。また、brassinosteroid関連の変異体は全て暗所での光形態形成に異常を示すことが知られているが、rot3変異体は正常な暗所形態形成を示した。このことから、ROT3遺伝子が直接brassinosteroid合成に関与している可能性は低いと考えられた。 ROT3遺伝子の機能と形態形成制御との関連を知る目的から、変異体ごとに転写レベルでの確認を行なった。その結果、速中性子線処理に由来するrot3-1変異では発現が検出されず、EMS処理で得られたrot3-2変異では野生型と同程度の発現が、またT-DNAタグに由来するrot3-3変異では低いレベルの発現が認められた。そこで各アリルについて、ROT3遺伝子上の変異部位の確認を行なったところ、EMS処理で得られたrot3-2変異ではproline-richドメインにおける80番目のGlyがGluに置換されていることが判明した。このproline-richドメインは全てのP450で保存されており、基質との結合に重要な役割をしていることが知られている。このことから、rot3-2変異による表現型の変化は、アミノ酸の置換によって、本来のROT3の機能が変化したためであると考えられた。したがって、ROT3遺伝子の本来の機能対象は、null変異であるrot3-1,rot3-3が示すように、葉に特異的であると考えられる。また組織ごとのmRNA発現パターンを調べた結果、ROT3遺伝子は植物体の全組織で発現していることが判明した。特に細胞分裂が活発に行われている組織において、比較的強い発現が見られることから、ROT3遺伝子は細胞分裂期に発現され、細胞伸長部位に間接的に影響を与えている可能性も考えられる。 第二章では、誘導性プロモーターの制御下に、ROT3遺伝子とrot3-2変異型遺伝子とを、null変異体であるrot3-1変異体に発現させたトランスジェニック植物を作成し、相補性テストと共に過剰発現による形態変化の解析を行なった。その結果、ROT3遺伝子の過剰発現を行なうことで葉身と葉柄の長さの増大が認められた。特に3コピー分がゲノムに挿入された株では、野生型やrot3変異体と異なり、葉の先端が尖るなどの表現型が認められた。また花弁においても極性伸長の変化が認められた。また、rot3-2変異型遺伝子を発現させたトランスジェニック植物は、rot3-2変異体と同様な表現型を示すことが認められた。さらに、細胞レベルでの変化を調べるため、解剖学的な解析を行なった。その結果、葉の長軸方向への細胞の極性伸長の増大が確認された。以上の結果より、ROT3遺伝子は葉細胞の極性伸長制御の鍵となる遺伝子であることが再確認できた。 本論文の結論を要約すると以下の通りである。 葉の極性伸長を司るROT3遺伝子に関し、その機能を詳しく調べるため、rot3-1変異体とアレリックな変異体を新たに単離し、解剖学的な解析を行なった。T-DNAタギング法を用い、ROT3遺伝子のクローニングを行なった結果、ROT3遺伝子はチトクロムP450ファミリーの1つ、CYP90C1をコードすることが判明した。 葉身と茎において細胞伸長が増大するという特徴的な表現型を示すrot3-2変異では、proline-richドメインにおける80番目のGlyがGluに置換されていることが判明した。ROT3遺伝子が葉細胞の極性伸長を支配する重要な遺伝子であることを、以上の変異体の遺伝学的解析と相補性テスト、及びトランスジェニック植物における過剰発現による系で確認した。 以上のように本研究では、葉細胞の極性伸長を司る遺伝子を世界で初めて単離すると共に、その機能を明らかにした。今後ROT3遺伝子のプロモータ領域の解析や、ROT3遺伝子の翻訳産物を用いた生化学的解析を通し、葉の伸長制御におけるより正確なROT3遺伝子の役割を、また葉の伸長制御の分子メカニズムを明らかにできると考えられる。以上の成果は、葉の形態形成における重要な因子を分子レベルで明らかにした点で高く評価される。今後、詳細な葉の形態形成過程を解明する上で重要な基盤を築いたものと考えられる。 尚、本論文は、塚谷裕一氏と内宮博文氏との共同研究であるが、論文提出者が主体となって、分析および検証を行なったもので、論文提出者の寄与が十分あると判断する。したがって、博士(理学)の学位を授与できると認める。 |