| 内容要旨 | | <序> 真核細胞のさまざまなオルガネラがその機能を維持するためには,新生タンパク質がそれぞれ正しい場所にソーティング(選別輸送)されなければならない.この細胞にとってきわめて重要な機能は,基本的にタンパク質自身が持つ局在化シグナルとその認識によって成り立っている.分泌経路の出発点である小胞体は,タンパク質の合成・高次構造形成・修飾の場であるとともに,脂質合成の主要な場でもある.これら多様な機能を効率良く果たすためには,小胞体構成タンパク質が分泌タンパク質などから正しく選別され局在化される必要がある. 酵母SEC12遺伝子産物(Sec12p)は,小胞体からの輸送小胞の形成に必須な膜タンパク質である.Sec12pは既知の小胞体局在化シグナルを持たないが,定常状態で大部分が小胞体に局在し,Sar1p依存的に形成される輸送小胞上にほとんど検出されない.しかし,Sec12pはゆっくりではあるがゴルジ体シス領域特異的な糖修飾を受ける.これらの観察から,Sec12pの小胞体局在化は,積極的に輸送小胞から排除される(retention,残留)機構と,漏れ出てしまった分子をゴルジ体から逆向きに送り返す(retrieval,逆送)機構によって厳密に規定されていると考えられる.これらのメカニズムを解明するため,西川はSec12-Mf 1融合タンパク質をレポーターに用いてSec12pの局在異常を示す変異株rer1,rer2を単離した(図1;Nishikawa and Nakano,1993).このうち野生型RER1遺伝子は,Sec12pを含む一群の膜タンパク質のretrieval機構に必要なゴルジ体膜タンパク質をコードしていることが明らかにされている(K.Sato et al.,1995,1997).一方,未同定であったSec12pの局在化シグナルについて解析を行い,その膜貫通領域がRER1依存性のretreivalシグナルとして,また細胞質領域がRER1非依存性のretentionシグナルとして機能することを見い出した(M.Sato,master thesis). 1融合タンパク質をレポーターに用いてSec12pの局在異常を示す変異株rer1,rer2を単離した(図1;Nishikawa and Nakano,1993).このうち野生型RER1遺伝子は,Sec12pを含む一群の膜タンパク質のretrieval機構に必要なゴルジ体膜タンパク質をコードしていることが明らかにされている(K.Sato et al.,1995,1997).一方,未同定であったSec12pの局在化シグナルについて解析を行い,その膜貫通領域がRER1依存性のretreivalシグナルとして,また細胞質領域がRER1非依存性のretentionシグナルとして機能することを見い出した(M.Sato,master thesis).  図1. 図1. 接合因子前駆体との融合タンパク質の生合成経路.融合タンパク質がゴルジ体trans領域にまで輸送されると,その量に応じて成熟型 接合因子前駆体との融合タンパク質の生合成経路.融合タンパク質がゴルジ体trans領域にまで輸送されると,その量に応じて成熟型 接合因子が分泌される.分泌量はハローアッセイにより定量できる. 接合因子が分泌される.分泌量はハローアッセイにより定量できる. 本研究では,このSec12pのRER1依存性シグナルに関してさらに詳細な変異体解析を行った.また,もう一つのrer変異株,rer2について解析を進め,野生型RER2遺伝子がドリコール合成系の鍵酵素,cis-プレニルトランスフェラーゼをコードしていることをつきとめた.これは本酵素の初めての同定であるとともに,ドリコールという脂質の細胞内機能を考える上で非常に興味深い発見であると考えている. <結果と考察>1)RER1依存性シグナルに関する変異体解析 RER1依存性シグナルのモチーフを抽出するため,Sec12pの膜貫通領域によって小胞体に局在化されるレポータータンパク質,DSDmを用いて変異体解析を行った(図2).膜貫通領域内の極性残基を単独,またはいくつかの組み合わせでアラニンに置換しても,局在化の効果はほとんど失われなかった.ところが,同様の置換をロイシンで行うと,対応するアラニン置換変異より強い効果があり,NQ-LやSY-L,L7ではRER1依存性がほとんど失われた.また,中央の疎水性残基のクラスターにロイシンを2個挿入してもやはり局在化の効果がなくなった.これらの結果から,RER1経路が認識するシグナルは一次配列ではなく,膜貫通領域内の極性残基の配置という構造的なモチーフであると考えられた.最近,RER1経路は一次配列上全く相同性のない複数の小胞体膜タンパク質の局在化に必要であることが示されたが(K.Sato et al.,1997),このこともRER1経路が認識するシグナルが単純な一次配列ではないことを支持している.またこの結果は,これまでに報告されているC末端のHDELやKKXX配列といったretreivalシグナルとは全く異なる新しいタイプのシグナルを同定したことを意味している.(M.Sato et al.,1996).  図2.Sec12pの膜貫通領域に関する変異体解析.Sec12p膜貫通領域に依存して小胞体に局在化されるレポーター,DSDmにおいて,膜貫通領域に様々な変異を導入し,その効果を 図2.Sec12pの膜貫通領域に関する変異体解析.Sec12p膜貫通領域に依存して小胞体に局在化されるレポーター,DSDmにおいて,膜貫通領域に様々な変異を導入し,その効果を 接合因子の分泌量により検討した.数値は,液胞タンパク質Dap2pとの融合タンパク質(DDDm)を発現する野生株が分泌する 接合因子の分泌量により検討した.数値は,液胞タンパク質Dap2pとの融合タンパク質(DDDm)を発現する野生株が分泌する 接合因子量を100%とした相対値であり,transゴルジ領域まで輸送されてしまったタンパク質量を反映している.2)rer2変異株と野生型RER2遺伝子に関する解析a.rer2変異株の表現型 接合因子量を100%とした相対値であり,transゴルジ領域まで輸送されてしまったタンパク質量を反映している.2)rer2変異株と野生型RER2遺伝子に関する解析a.rer2変異株の表現型 rer2変異株は生育が温度感受性であり,可溶性小胞体タンパク質BiPをも誤って分泌してしまう.加えて,不完全なN結合型糖鎖修飾,ハイグロマイシンB感受性,小胞体膜の蓄積などの多面的な表現型を示すことが報告されていた(Nishikawa,doctor thesis;K.Sato,master thesis).さらに解析を進めた結果,rer2はSec71pやSec63pといった小胞体膜タンパク質の局在化にも広く欠損を示すことを見出した.また,カルボキシペプチダーゼYやGas1pなどの糖タンパク質についてのパルスチェイス実験により,rer2はN結合型糖鎖だけでなく,O結合型糖鎖の修飾にも欠損があり,さらにそれらが温度感受性であることが明らかとなった(図3).細胞内形態についても詳しく調べたところ,小胞体膜だけでなくゴルジ体膜も異常なリング状の形態に変化し,蓄積していた. 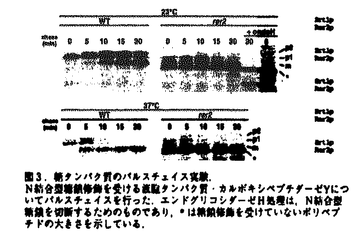 図3.糖タンパク質のパルスチェイス実験.N結合型糖鎖修飾を受ける液胞タンパク質・カルボキシペプチダーゼYについてパルスチェイスを行った.エンドグリコシダーゼH処理は,N結合型糖鎖を切断するためのものであり,*は糖鎖修飾を受けていないポリベブチドの大きさを示している.b.野生型RER2遺伝子の単離とその解析 図3.糖タンパク質のパルスチェイス実験.N結合型糖鎖修飾を受ける液胞タンパク質・カルボキシペプチダーゼYについてパルスチェイスを行った.エンドグリコシダーゼH処理は,N結合型糖鎖を切断するためのものであり,*は糖鎖修飾を受けていないポリベブチドの大きさを示している.b.野生型RER2遺伝子の単離とその解析 野生型RER2遺伝子のクローニングを行ったところ,286アミノ酸からなるタンパク質(Rer2p)をコードする新奇遺伝子を同定した.このRER2は,rer2変異株の多コピー抑圧遺伝子として西川により単離されていたSRT1と有為な相同性を示した(図4).Rer2pの一次配列上にはその機能を類推できるような情報はなかったが,各種生物のゲノム計画の進展により,大腸菌などの原核生物から線虫,シロイヌナズナにまで広くそのホモログが存在することがわかった.rer2破壊株は23℃でも著しい生育遅延を示し,rer2 srt1二重破壊株は致死であったことから,Rer2pファミリーは生物にとって基本的かつ必須な機能を担っていると推察された.  図4.Rer2pとSrt1pの比較. 図4.Rer2pとSrt1pの比較. Rer2pの性質を解析するため,N末端にHA-tagを挿入したタンパク質をコードする3HA-RER2を構築した.この3HA-RER2は単コピープラスミド上でrer2破壊株を完全に相補することができた.Rer2pは膜貫通領域となりうる配列を持たないが,3HA-Rer2pのほぼすべてが膜画分に存在し,塩や界面活性剤による可溶化実験により非常に強固に膜に結合していることが明らかとなった(図5).さらに,細胞分画による解析では小胞体膜タンパク質と挙動が一致したことから,Rer2pは小胞体表面に局在すると考えられた.しかし,間接蛍光抗体法で細胞内局在を調べたところ,小胞体上の点状の染色像が観察された(図6).このことは,Rer2pは通常の小胞体タンパク質のように小胞体膜上に一様に存在するのではなく,小胞体のあるサブドメインに局在することを示唆している.このような局在性は酵母においては非常に珍しく,酵母の小胞体もいくつかの機能的なサブドメインに分化している可能性を示している.  図5.(A)細胞分画法による3HA-Rer2pの細胞内局在の検討.3HA-Rer2pを単コピー上で発現しているrer2破壊株から細胞破砕液を調製し,13,000xg,100,000xgの分画遠心を行った.(B)3HA-Rer2pの可溶化の条件検討.細胞破砕液を図中の試薬で処理後,436,000xgで遠心した. 図5.(A)細胞分画法による3HA-Rer2pの細胞内局在の検討.3HA-Rer2pを単コピー上で発現しているrer2破壊株から細胞破砕液を調製し,13,000xg,100,000xgの分画遠心を行った.(B)3HA-Rer2pの可溶化の条件検討.細胞破砕液を図中の試薬で処理後,436,000xgで遠心した. 図6.間接蛍光抗体法による3HA-Rer2pの細胞内局在の観察.rer2破壊株に3HA-RER2を単コピーで導入した株を用い.小胞体マーカー・BiPとの二重染色を行った.A,抗BiP抗体;B,抗HA抗体;C,DAP1による染色像.c.cis-プレニルトランスフェラーゼとしてのRer2pの同定 図6.間接蛍光抗体法による3HA-Rer2pの細胞内局在の観察.rer2破壊株に3HA-RER2を単コピーで導入した株を用い.小胞体マーカー・BiPとの二重染色を行った.A,抗BiP抗体;B,抗HA抗体;C,DAP1による染色像.c.cis-プレニルトランスフェラーゼとしてのRer2pの同定 RER2ホモログは多くの生物に存在するが,その機能解析は全くなされていなかった.そこで,RER2ファミリーの機能を明らかにするために,東大医科研・加藤潤一博士との共同研究により,ゲノム計画で同定された大腸菌のRER2ホモログ(rth:RER-two homologue)の解析を行った.その結果,rth遺伝子は大腸菌においても生育に必須であり,その温度感受性変異株では制限温度下において細胞壁が全体的に強度を失い,細胞が膨張,破裂することがわかった(Kato et al.,submitted).原核生物の細胞壁の強度維持においてはペプチドグリカンが主要な役割を果たすが,われわれはこのペプチドグリカン合成と真核生物の糖鎖修飾との間に非常に良く似た機構が存在することに着目した(図7,8).ペプチドグリカン,またはN結合型糖鎖のいずれの合成においても,その一構造単位がまずキャリアリピド上に組み立てられた後,膜上で反転し,ペプチドグリカンやタンパク質に転位される.また,O結合型糖鎖の場合も,酵母ではキャリアリピドに結合したマンノースがドナーとなる.どの場合もキャリアリピドは長鎖ポリプレノールリン酸であり,ファルネシル二リン酸(FPP)上にイソペンテニル二リン酸(IPP)が重合することで合成される(図7).この反応は真核・原核生物どちらにおいても単一の酵素・cis-プレニルトランスフェラーゼにより触媒されることがわかっていたが,酵素自身は同定されていなかった.真核生物の場合はさらに数ステップの反応を経て最終的にドリコールリン酸がキャリアとして用いられるが,この反応経路もいまだ確立されていない.そこで,Rer2pファミリーがこのcis-プレニルトランスフェラーゼである可能性を以下で検証した.まず,rer2変異株から膜画分を調製し,in vitroでこの酵素活性を測定した(図9).実際,rer2ではcis-プレニルトランスフェラーゼ活性が野生株の約2.7%にまで減少していた.またこの欠損はRER2遺伝子を単コピーで導入することで完全に相補され,一方野生株に多コピーでRER2を導入すると活性が1.6倍に上昇した.また全細胞抽出液を用いて,FPPとIPPから分岐するすべてのイソプレイド合成系の活性を調べたが,rer2変異株ではドリコール合成のみが特異的に低下していた(図10).さらに,ドリコールキナーゼをコードするSEC59(図7,8)との遺伝的相互作用を調べたところ,Rer2pの過剰発現はsec59変異株の温度感受性を35℃まで回復させた.これは,de novoドリコール合成を上昇させることでドリコールキナーゼの欠損を部分的に抑圧すると説明できる.また逆に rer2sec59二重変異株は合成致死性を示した.これらの結果から,Rer2pはドリコール合成系の最初の酵素・cis-プレニルトランスフェラーゼであると結論した.このことは,rer2が糖鎖修飾に広く欠損を持つこととよく一致している.しかし,小胞体タンパク質の局在化異常や膜構造の蓄積などの現象も単に糖鎖修飾一般の欠損による効果なのだろうか?現時点でこの可能性を完全に否定することはできないが,rer2同様すべての糖鎖修飾に欠損が生じるsec53,sec5変異株,またN結合型糖鎖合成に欠損を持つalg変異株等(図8)に関しては,rer2のような膜機能の異常は報告されていない.これらの変異株とrer2変異株では,ドリコール自体が合成されるか否かという点が大きく異なっており,変異株の表現型の差は,ドリコールにキャリアリピド以外の細胞内機能が存在する可能性を示している.in vitroの実験ではあるが,ドリコール類はリン脂質二重膜の物理化学的な性質を変化させることも報告されており,これらの脂質が小胞体膜マイクロドメインの性質を変化させることで,小胞形成と分子選別をコントロールしているのかもしれない.今後は,rer2とsec53,sec59変異株との詳しい比較検討が重要なテーマであろう. rer2sec59二重変異株は合成致死性を示した.これらの結果から,Rer2pはドリコール合成系の最初の酵素・cis-プレニルトランスフェラーゼであると結論した.このことは,rer2が糖鎖修飾に広く欠損を持つこととよく一致している.しかし,小胞体タンパク質の局在化異常や膜構造の蓄積などの現象も単に糖鎖修飾一般の欠損による効果なのだろうか?現時点でこの可能性を完全に否定することはできないが,rer2同様すべての糖鎖修飾に欠損が生じるsec53,sec5変異株,またN結合型糖鎖合成に欠損を持つalg変異株等(図8)に関しては,rer2のような膜機能の異常は報告されていない.これらの変異株とrer2変異株では,ドリコール自体が合成されるか否かという点が大きく異なっており,変異株の表現型の差は,ドリコールにキャリアリピド以外の細胞内機能が存在する可能性を示している.in vitroの実験ではあるが,ドリコール類はリン脂質二重膜の物理化学的な性質を変化させることも報告されており,これらの脂質が小胞体膜マイクロドメインの性質を変化させることで,小胞形成と分子選別をコントロールしているのかもしれない.今後は,rer2とsec53,sec59変異株との詳しい比較検討が重要なテーマであろう. 本研究により,タンパク質選別輸送の研究に脂質という新たな観点を導入できた.また,いまだ謎に包まれているドリコールの合成経路,脂質としての細胞内機能の解明に向けて,このcis-プレニルトランスフェラーゼの同定が新たな方向性を示すとともに問題解決の突破口になると考えている.  図7.(A)長鎖ポリプレノールのキャリアリピドとしての機能.(B)ドリコールの合成経路.FPP(famesyl diphosphate)とIPP(isopentenyl diphosphate)はエルゴステロールやユビキノン合成にも用いられる. 図7.(A)長鎖ポリプレノールのキャリアリピドとしての機能.(B)ドリコールの合成経路.FPP(famesyl diphosphate)とIPP(isopentenyl diphosphate)はエルゴステロールやユビキノン合成にも用いられる.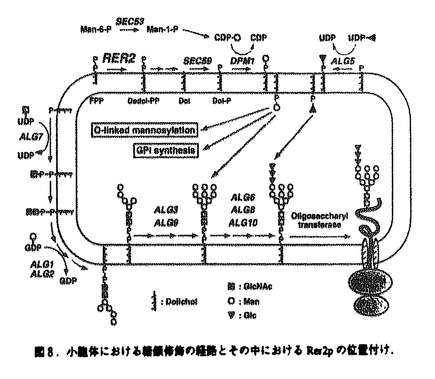 図8.小胞体における糖鎖修飾の経路とその中におけるRer2pの位置付け. 図8.小胞体における糖鎖修飾の経路とその中におけるRer2pの位置付け. 図9.rer2破壊株におけるcis-プレニルトランスフェラーゼ活性.各細胞から膜画分を調製し,FPPと[1-14C]IPPを基質に用いて酵素活性を測定した. 図9.rer2破壊株におけるcis-プレニルトランスフェラーゼ活性.各細胞から膜画分を調製し,FPPと[1-14C]IPPを基質に用いて酵素活性を測定した. 図10.rer2変異株のイソプレノイド合成活性.各細胞から全細胞抽出液を調製し,FPPと[1-14C]IPPを基質に反応を行った.反応産物を薄層クロマトグラフィーで分離し,3つのイソプレノイド合成経路(図7.B参照)の活性を調べた.rer2変異株ではドリコールの合成のみが特異的に低下していた. 図10.rer2変異株のイソプレノイド合成活性.各細胞から全細胞抽出液を調製し,FPPと[1-14C]IPPを基質に反応を行った.反応産物を薄層クロマトグラフィーで分離し,3つのイソプレノイド合成経路(図7.B参照)の活性を調べた.rer2変異株ではドリコールの合成のみが特異的に低下していた. |
| 審査要旨 | | 真核細胞のさまざまなオルガネラがその機能を維持するためには,新生タンパク質がそれぞれ正しい場所にソーティング(選別輸送)されなければならない.この細胞にとってきわめて重要な機能は,基本的にタンパク質自身が持つ局在化シグナルとその認識によって成り立っている.分泌経路の出発点である小胞体は,タンパク質の合成・高次構造形成・修飾の場であるとともに,脂質合成の主要な場でもある.これら多様な機能を効率良く果たすためには,小胞体構成タンパク質が分泌タンパク質などから正しく選別され局在化される必要がある.本論文の第1章では、小胞体からの輸送小胞の形成に必須な膜タンパク質であるSec12pがどのような機構で小胞体に維持されるかについて調べ、Sec12pの膜貫通領域と細胞質領域がそれぞれ異なる機構でSec12pの局在に係わることを明らかにしている。第2章では、Sec12pの局在異常変異の一つRer2変異体の原因遺伝子がドリコール合成系の鍵酵素,cis-プレニルトランスフェラーゼをコードしていることを明らかにしている。各章の概要は以下の通りである。 第1章RER1依存性シグナルに関する変異体解析 RER1依存性シグナルのモチーフを抽出するため,Sec12pの膜貫通領域によって小胞体に局在化されるレポータータンパク質,DSDmを用いて変異体解析を行った.膜貫通領域内の極性残基を単独,またはいくつかの組み合わせでアラニンに置換しても,局在化の効果はほとんど失われなかった.ところが,同様の置換をロイシンで行うと,対応するアラニン置換変異より強い効果があり,NQ-LやSY-L,L7ではRER1依存性がほとんど失われた.また,中央の疎水性残基のクラスターにロイシンを2個挿入してもやはり局在化の効果がなくなった.これらの結果から,RER1経路が認識するシグナルは一次配列ではなく,膜貫通領域内の極性残基の配置という構造的なモチーフであると考えられた.最近,RER1経路は一次配列上全く相同性のない複数の小胞体膜タンパク質の局在化に必要であることが示されたが,このこともRER1経路が認識するシグナルが単純な一次配列ではないことを支持している.またこの結果は,これまでに報告されているC末端のHDELやKKXX配列といったretreivalシグナルとは全く異なる新しいタイプのシグナルを同定したことを意味している. 第2章rer2変異株と野生型RER2遺伝子に関する解析a.rer2変異株の表現型 rer2変異株は生育が温度感受性であり,可溶性小胞体タンパク質BiPをも誤って分泌してしまう.加えて,不完全なN結合型糖鎖修飾,ハイグロマイシンB感受性,小胞体膜の蓄積などの多面的な表現型を示すことが報告されていた.さらに解析を進めた結果,rer2はSec71pやSec63pといった小胞体膜タンパク質の局在化にも広く欠損を示すことを見出した.また,カルボキシペプチダーゼYやGaslpなどの糖タンパク質についてのパルスチェイス実験により,rer2はN結合型糖鎖だけでなく,O結合型糖鎖の修飾にも欠損があり,さらにそれらが温度感受性であることが明らかとなった.細胞内形態についても詳しく調べたところ,小胞体膜だけでなくゴルジ体膜も異常なリング状の形態に変化し,蓄積していた. b.野生型RER2遺伝子の単離とその解析 野生型RER2遺伝子のクローニングを行ったところ,286アミノ酸からなるタンパク質(Rer2p)をコードする新奇遺伝子を同定した.このRER2は,rer2変異株の多コピー抑圧遺伝子として西川により単離されていたSRT1(Suppressor of rer-two)と有為な相同性を示した.Rer2pの一次配列上にはその機能を類推できるような情報はなかったが,各種生物のゲノム計画の進展により,大腸菌などの原核生物から線虫,シロイヌナズナにまで広くそのホモログが存在することがわかった.rer2破壊株は23℃でも著しい生育遅延を示し,rer2 srt1二重破壊株は致死であったことから,Rer2pファミリーは生物にとって基本的かつ必須な機能を担っていると推察された. Rer2pの性質を解析するため,N末端にHA-tagを挿入したタンパク質をコードする3HA-RER2を構築した.この3HA-RER2は単コピープラスミド上でrer2破壊株を完全に相補することができた.Rer2pは膜貫通領域となりうる配列を持たないが,3HA-Rer2pのほぼすべてが膜画分に存在し,塩や界面活性剤による可溶化実験により非常に強固に膜に結合していることが明らかとなった.さらに,細胞分画による解析では小胞体膜タンパク質と挙動が一致したことから,Rer2pは小胞体表面に局在すると考えられた.しかし,間接蛍光抗体法で細胞内局在を調べたところ,小胞体上の点状の染色像が観察された.このことは,Rer2pは通常の小胞体タンパク質のように小胞体膜上に一様に存在するのではなく,小胞体のあるサブドメインに局在することを示唆している.このような局在性は酵母においては非常に珍しく,酵母の小胞体もいくつかの機能的なサブドメインに分化している可能性を示している. c.cis-プレニルトランスフェラーゼとしてのRer2pの同定 RER2ホモログは多くの生物に存在するが,その機能解析は全くなされていなかった.そこで,RER2ファミリーの機能を明らかにするために,東大医科研・加藤潤一博士との共同研究により,ゲノム計画で同定された大腸菌のRER2ホモログ(rth:RER-two homologue)の解析を行った.その結果,rth遺伝子は大腸菌においても生育に必須であり,その温度感受性変異株では制限温度下において細胞壁が全体的に強度を失い,細胞が膨張,破裂することがわかった.原核生物の細胞壁の強度維持においてはペプチドグリカンが主要な役割を果たすが,われわれはこのペプチドグリカン合成と真核生物の糖鎖修飾との間に非常に良く似た機構が存在することに着目した.ペプチドグリカン,またはN結合型糖鎖のいずれの合成においても,その一構造単位がまずキャリアリピド上に組み立てられた後,膜上で反転し,ペプチドグリカンやタンパク質に転位される.また,O結合型糖鎖の場合も,酵母ではキャリアリピドに結合したマンノースがドナーとなる.どの場合もキャリアリピドは長鎖ポリプレノールリン酸であり,ファルネシル二リン酸(FPP)上にイソペンテニル二リン酸(IPP)が重合することで合成される.この反応は真核・原核生物どちらにおいても単一の酵素・cis-プレニルトランスフェラーゼにより触媒されることがわかっていたが,酵素自身は同定されていなかった.真核生物の場合はさらに数ステップの反応を経て最終的にドリコールリン酸がキャリアとして用いられるが,この反応経路もいまだ確立されていない.そこで,Rer2pファミリーがこのcis-プレニルトランスフェラーゼである可能性を以下で検証した.まず,rer2変異株から膜画分を調製し,in vitroでこの酵素活性を測定した.実際,rer2ではcis-プレニルトランスフェラーゼ活性が野生株の約2.7%にまで減少していた.またこの欠損はRER2遺伝子を単コピーで導入することで完全に相補され,一方野生株に多コピーでRER2を導入すると活性が1.6倍に上昇した.また全細胞抽出液を用いて,FPPとIPPから分岐するすべてのイソプレイド合成系の活性を調べたが,rer2変異株ではドリコール合成のみが特異的に低下していた.さらに,ドリコールキナーゼをコードするSEC59との遺伝的相互作用を調べたところ,Rer2pの過剰発現はsec59変異株の温度感受性を35℃まで回復させた.これは,de novoドリコール合成を上昇させることでドリコールキナーゼの欠損を部分的に抑圧すると説明できる.また逆に rer2 sec59二重変異株は合成致死性を示した.これらの結果から,Rer2pはドリコール合成系の最初の酵素・cis-プレニルトランスフェラーゼであると結論した.このことは,rer2が糖鎖修飾に広く欠損を持つこととよく一致している.しかし,小胞体タンパク質の局在化異常や膜構造の蓄積などの現象も単に糖鎖修飾一般の欠損による効果なのだろうか?現時点でこの可能性を完全に否定することはできないが,rer2同様すべての糖鎖修飾に欠損が生じるsec53,sec59変異株,またN結合型糖鎖合成に欠損を持つalg変異株等に関しては,rer2のような膜機能の異常は報告されていない.これらの変異株とrer2変異株では,ドリコール自体が合成されるか否かという点が大きく異なっており,変異株の表現型の差は,ドリコールにキャリアリピド以外の細胞内機能が存在する可能性を示している.in vitroの実験ではあるが,ドリコール類はリン脂質二重膜の物理化学的な性質を変化させることも報告されており,これらの脂質が小胞体膜マイクロドメインの性質を変化させることで,小胞形成と分子選別をコントロールしているのかもしれない.今後は,rer2とsec53,sec59変異株との詳しい比較検討が重要なテーマであろう. rer2 sec59二重変異株は合成致死性を示した.これらの結果から,Rer2pはドリコール合成系の最初の酵素・cis-プレニルトランスフェラーゼであると結論した.このことは,rer2が糖鎖修飾に広く欠損を持つこととよく一致している.しかし,小胞体タンパク質の局在化異常や膜構造の蓄積などの現象も単に糖鎖修飾一般の欠損による効果なのだろうか?現時点でこの可能性を完全に否定することはできないが,rer2同様すべての糖鎖修飾に欠損が生じるsec53,sec59変異株,またN結合型糖鎖合成に欠損を持つalg変異株等に関しては,rer2のような膜機能の異常は報告されていない.これらの変異株とrer2変異株では,ドリコール自体が合成されるか否かという点が大きく異なっており,変異株の表現型の差は,ドリコールにキャリアリピド以外の細胞内機能が存在する可能性を示している.in vitroの実験ではあるが,ドリコール類はリン脂質二重膜の物理化学的な性質を変化させることも報告されており,これらの脂質が小胞体膜マイクロドメインの性質を変化させることで,小胞形成と分子選別をコントロールしているのかもしれない.今後は,rer2とsec53,sec59変異株との詳しい比較検討が重要なテーマであろう. 以上のように、本研究は,タンパク質選別輸送の研究に脂質という新たな観点を導入し、また,cis-プレニルトランスフェラーゼの同定は、いまだ謎に包まれているドリコール脂質の細胞内機能の解明への突破口になるものと期待される.本論文2編は共著であるが、実験計画とその遂行は申請者によって行われた。以上の評価に基づき、本研究は博士(理学)の学位に十分値するものであることが、審査委員全員の一致により認められた。 |