硫酸同化とは、細胞内に取り込んだ硫酸イオンを還元して、システインを生成する一連の反応系で、真正細菌、菌類、植物にあり、真正細菌と高等植物の反応系は類似していることがわかっている(図1)。硫酸同化によるシステイン合成は、タンパク質やグルタチオンなどのイオウ化合物の生成へとつながるだけでなく、その活性は硫酸耐性と関わりがあるという上でも重要である(Youssefian et al.1993;Saito et al.1994)。 植物のシステイン合成は、高等植物を材料に研究され、大腸菌と同様、セリンアセチルトランスフェラーゼ(SAT)と、OASチオールライエース(OASTL)により行われること、またこれらの酵素にはそれぞれ色素体型、ミトコンドリア型、細胞質型の3つのイソフォームがあることが、生化学的に(Schmidt 1986)、また、分子生物学的に(Saito 1992,1995;Leustek 1996)明らかにされた。しかし、これまでSATとOASTLは、おもに高等植物で研究され、遺伝子は高等植物以外の植物では同定されていない。また、硫酸同化は、中性で、比較的硫酸濃度の低い環境で生息する生物のみが研究対象とされてきた。酸性で、しかも硫酸濃度の高い環境に生息する生物では、より高い硫酸同化機能を持つ可能性がある。 イタリアのイオウ温泉原産の原始紅藻Cyanidioschyzon merolaeは、pH2.5で、通常の植物の最適な硫酸イオン濃度2mMと比べて高濃度な10mMの酸性の培地に適して増殖する。また、細胞内に核、ミトコンドリア、色素体が一つずつこの順にならんでいるので、遺伝子産物の局在も調べやすい。 そこで、本研究ではC.merolaeのシステイン合成の基本的なしくみを明らかにするために、システイン合成に関与するSATとOASTLの遺伝子をC.merolaeから単離し、性質、特徴を明らかにすることにした。修士の過程でC.merolaeの最小の420kbpの染色体を解析中に、SAT遺伝子の一部をみつけ、全長を決定し、cmSAT1とした。C.merolaeも高等植物と同様SATのイソフォームを持つ可能性があったので、C.merolaeのゲノミックDNAをもちいてディジェネレートPCRを行ったところ、cmSAT1と、それとは異なるタイプのSAT遺伝子断片を検出したので全長を決定し、cmSAT2とした。(以下、SAT1、SAT2と略す。)SAT1、SAT2とも大腸菌やスイカの細胞質型のSATと比較して、N末が110アミノ酸ほど長く、オルガネラへの輸送ペプチドをもつものと思われた。輸送ペプチドと思われる部分を除くと、SAT1、SAT2はお互い50%の相同性を示し、他の生物のSATと比較しても酵素活性に関わるC末側がよく保存されていた(図2)。PCR断片をプローブに、ゲノミックサザンハイブリダイゼーションを行ったところSAT1、SAT2ともにシングルコピーであることがわかった(図3)。また、パルスフィールドゲル電気泳動(PFGE)で分離した染色体DNAへのサザンハイブリダイゼーションから、SAT2は第9番染色体にあることがわかった(図4)。ノーザンハイブリダイゼーションで転写産物の蓄積を調べた結果、SAT1に関しては2.4kbのシングルバンドを検出し、SAT2に関してはSAT1と比べて弱い2.4kb、1.9kbの2本のバンドを検出した(図5)。2.4kbのバンドはSAT1を検出していると思われる。ゲノミックサザンハイブリダイゼーションで、SAT2遺伝子断片は、SAT1遺伝子の場所に弱いシグナルを示したが、SAT1はSAT2を検出しなかったので、まだ他にSAT遺伝子のイソフォームがある可能性があったが、見つかったSAT1、SAT2を比較しつつ、この原始紅藻のSATの性質を調べることにした。 SAT1、SAT2の性質を調べるため、それぞれ輸送ペプチドと思われる部分をカットして他の生物のSATと相同性のある部分を残した遺伝子断片を調整した。SAT1、SAT2遺伝子断片をそれぞれ大腸菌発現ベクターpQE-32、pQE-30に組み込み、pQE-SAT1、pQE-SAT2とした。SATの活性を持たないシステイン要求性変異株JM15にpQE-SAT1、pQE-SAT2を導入しそれぞれJM15-SAT1,JM15-SAT2とした。最小培地で相補性を調べた結果、JM15-SAT1は、寒天培地、液体培地とも野生株より増殖がはやくなる傾向がみられた(図6、図7)。JM15-SAT2に関しては、増殖はみられなかった。また、形質転換した大腸菌の粗抽出物でSAT活性を測定すると、JM15-SAT1からのみ、野性株JM109と同様の活性が検出され、JM15-SAT2からは検出されなかった。pQE-SAT1はN末にヒスチヂンタグのついた融合タンパク質を発現するので、ヒスチヂンと親和性のあるニッケルカラムを使ってSAT活性を濃縮することができた。この活性は、システインで阻害された(表1)。SAT1のKm値を求めるために、基質濃度と酵素活性の逆数プロットをとった結果、アセチルCoA、セリンに対してそれぞれ0.3mM、0.1mMという値を得た(図8)。SAT1のシステインによる活性阻害やKm値は、大腸菌のものと類似していた。 大腸菌で顕著な活性の見られたSAT1のC.merolaeでの発現を調べるために、強制発現したSAT1融合タンパク質をニッケルカラムで精製し、抗SAT1抗体を作製した。この抗SAT1抗体を用いて、C.merolaeの粗抽出物に対してウェスタンブロッティングを行ったところ、31kDaにシングルバンドを検出した。この値は、他の生物のSATに共通しており、また、SAT1のN末110アミノ酸を除いて予測される分子量と一致した。次に、細胞周期のSAT1の発現を調べるために、光の明暗で細胞周期を同調した株を用いてRNAを抽出し、ノーザンハイブリダイゼーションを行った結果、2.4kbのシングルバンドがどの細胞のステージでも検出された。そこで、同じサンプルを用いて細胞の粗抽出物に対してウェスタンブロッティングを行ったところ、同程度の強度のシグナルが31kDaのところに見られたので、SAT1は恒常的に発現することがわかった(図9)。また、暗期には、45kDaのバンドの増加がみられた。45kDaという値は、SAT1タンパク質の全長の推定分子量43kDaとほぼ一致するので、現在のところ、N末の輸送ペプチドが切られる前の状態を検出していると考えている。タンパク質の発現は、硫酸欠乏条件や、暗条件でも変化が見られなかった(図10)。 SAT1の局在を、急速凍結法で処理し、LRホワイトで胞埋した細胞の切片を用いて免疫電子顕微鏡法で調べた。ネガティブコントロールの免疫前の血清、ポジティブコントロールである抗ルビスコ抗体と比較すると、抗SAT1抗体は葉緑体と細胞質に反応していることがわかった(図11)。面積あたりの金コロイド数を統計的に処理した結果からも、金コロイドは葉緑体と細胞質にあることが示された(表2)。C.merolaeの葉緑体の体積は、細胞体積の大半をしめているので、SAT1は主に葉緑体に存在するものと考えられる。細胞質の金コロイドは、葉緑体に輸送される前のSAT1であると現在考えている。 OASTLは、SATと同様、真正細菌と植物に共通な酵素である。真正細菌にはこの酵素はAタイプとBタイプの2種類が存在するが、真核生物からはBタイプはみつかっておらず、酵素活性も報告がない。A、Bタイプとも、OASと硫化物からシステインを合成することができるが、BタイプにはOASとチオ硫酸からスルフォシステインを合成するというAタイプにはない機能がある(図12)。私は、C.merolaeにAタイプ、Bタイプが存在するのか調べるために、真正細菌のAタイプ、Bタイプと高等植物のOASTLに共通なアミノ酸配列からプライマーを設計し、ディジェネレートPCRを行った。その結果、OASTL遺伝子断片とおもわれるものを4種類検出したのでそれぞれcmOASTL1、cmOASTL2、cmOASTL3、cmOASTL4とした。(以下、SAT遺伝子と同様OASTL1…と略す。)検出したDNA断片をプローブにゲノミックサザンハイブリダイゼーションを行ったところ、全てシングルコピーであることがわかった(図13)。また、PFGEで分離した染色体DNAへのサザンハイブリダイゼーションから、OASTL1、OASTL3は第17番染色体、OASTL2、OASTL4は第8番染色体にあることがわかった(図14)。 4つのOASTL遺伝子断片のDNA配列、アミノ酸配列を比較すると、OASTL1、2とOASTL3、4は互いに非常によく似ていた。OASTL1、OASTL2とOASTL3、OASTL4は相同性から2グループに別れたので、C.merolaeがAタイプ、Bタイプ両方のOASTLを持つ可能性がでてきた。そこで、OASTL1、OASTL4を選んでさらに解析することにした。OASTL1、OASTL4遺伝子の全長を決定した結果、OASTL1とOASTL4のアミノ酸配列は互いに33%の相同性しかみられなかった(図15)。この2つのOASTLの機能を調べるため、SATの実験と同様、他の生物のOASTLと相同性を示した部分をpQEベクターに組み込み、OASTLA、B両方の機能が欠損した大腸菌NK3に導入して、NK3-OASTL1、NK3-OASTL4とした。寒天上ではOASTL1のみ相補性を示し、液体培地では、両方、相補性を示した(図16)。また、OASTL1、OASTL4がBタイプか調べるため、イオウ原として硫化ナトリウムのかわりにチオ硫酸を添加した液体の最小培地を用いた。その結果、NK3-OASTL1のみ、増殖がみられた(図17)。チオ硫酸は、pH4.6以下の酸性条件や熱により分解されやすいので、C.merolaeは細胞内でチオ硫酸を生成して利用していることが考えられる。  図1.高等植物における硫酸同化.植物は、細胞内に取り込んだ硫酸を葉緑体内で還元して、システインを合成する.システイン合成には、SATとOASTLの2酵素が関わる.システイン合成能はミトコンドリアと細胞質からも検出されているが、葉緑体でのみ硫酸同化の全反応系がそろっていると考えられている. 図1.高等植物における硫酸同化.植物は、細胞内に取り込んだ硫酸を葉緑体内で還元して、システインを合成する.システイン合成には、SATとOASTLの2酵素が関わる.システイン合成能はミトコンドリアと細胞質からも検出されているが、葉緑体でのみ硫酸同化の全反応系がそろっていると考えられている. 図2.C.merolaeの2つのSATイソフォームの推定アミノ酸配列.報告されているホウレンソウ(Soito et al 1996)、シロイヌナズナSat-1(Roberts and Wray 1996)、シロイヌナズナSat-52(Howarth et al 1997)、スイカ(Saito et al 1995)、大腸菌(Denk and Bock 1987)のものと比較し、最下段に全てに共通な配列を示した."-"は相同なアミノ酸を表す. 図2.C.merolaeの2つのSATイソフォームの推定アミノ酸配列.報告されているホウレンソウ(Soito et al 1996)、シロイヌナズナSat-1(Roberts and Wray 1996)、シロイヌナズナSat-52(Howarth et al 1997)、スイカ(Saito et al 1995)、大腸菌(Denk and Bock 1987)のものと比較し、最下段に全てに共通な配列を示した."-"は相同なアミノ酸を表す. 図3.C.merolae核DNAに対するcmSAT1およびcmSAT2のグノミックサザン.1は、BamHI、2はEcoRI、3はEcoRV、4はHindill、5はKpnlで切断したDNAを使用.cmSAT2はcmSAT1にクロスハイブリする. 図3.C.merolae核DNAに対するcmSAT1およびcmSAT2のグノミックサザン.1は、BamHI、2はEcoRI、3はEcoRV、4はHindill、5はKpnlで切断したDNAを使用.cmSAT2はcmSAT1にクロスハイブリする.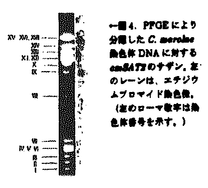 図4.PFGEにより分離したC.merolae染色体DNAに対するcmSAT2のサザン.左のレーンは、エチジウムブロマイド染色像.(左のローマ数字は染色体番号を示す.) 図4.PFGEにより分離したC.merolae染色体DNAに対するcmSAT2のサザン.左のレーンは、エチジウムブロマイド染色像.(左のローマ数字は染色体番号を示す.) 図5.C.merolaeの全RNAに対するcmSAT1、cmSAT2のノーザン. 図5.C.merolaeの全RNAに対するcmSAT1、cmSAT2のノーザン. 図6.寒天培地によるSAT1、SAT2の相補試験.植菌後2日目の写真.JM15はSAT活性のない変異株.XL1-BlueはSAT活性が正常なポジティプコントロール.JM15-SAT1はXL1-Blueよりはやく増殖したが、JM15-SAT2には増殖は見られなかった. 図6.寒天培地によるSAT1、SAT2の相補試験.植菌後2日目の写真.JM15はSAT活性のない変異株.XL1-BlueはSAT活性が正常なポジティプコントロール.JM15-SAT1はXL1-Blueよりはやく増殖したが、JM15-SAT2には増殖は見られなかった. 表1.JM15-SAT1の粗抽出物(1)および精製した融合タンパク質(2-5)の酵素活性.JM109はポジティプコントロール.JM15はネガティプコントロールである.精製した活性(2)はシステイン添加により阻害された(3-5). 表1.JM15-SAT1の粗抽出物(1)および精製した融合タンパク質(2-5)の酵素活性.JM109はポジティプコントロール.JM15はネガティプコントロールである.精製した活性(2)はシステイン添加により阻害された(3-5). 図7.大腸菌の増殖曲線.横軸は、植え継ぎ後の時間(h)、縦軸は培養液の550nmでの吸光度.・;JM15-SAT1.▲;JM15-SAT2.〇;JM109(ポジティプコントロール)□;JM15(ネガティプコントロール).JM15-SAT1とJM109は3回サンプリングしてある。JM15-SAT1はJM109より増殖がはやい傾向が見られた. 図7.大腸菌の増殖曲線.横軸は、植え継ぎ後の時間(h)、縦軸は培養液の550nmでの吸光度.・;JM15-SAT1.▲;JM15-SAT2.〇;JM109(ポジティプコントロール)□;JM15(ネガティプコントロール).JM15-SAT1とJM109は3回サンプリングしてある。JM15-SAT1はJM109より増殖がはやい傾向が見られた. 図8.cmSAT1に関する基質濃度(横軸)と酵素活性(縦軸)の逆数プロット.アセチルCoAに関して0.3mM(左)、セリンに関して0.1mM(右)という値を得た. 図8.cmSAT1に関する基質濃度(横軸)と酵素活性(縦軸)の逆数プロット.アセチルCoAに関して0.3mM(左)、セリンに関して0.1mM(右)という値を得た. 図9.明暗同調下の各時期のC.merolae全RNAに対するcmSAT1のノーザン(A)と、細胞の粗抽出物に対する抗SAT1抗体を用いたウェスタンブロッティング(B).それぞれ第2暗期Oh(レーン1)、4h(レーン2)、8h(レーン3)、12h(レーン4)、第3明期4h(レーン5)、8h(レーン6)にサンプリングした細胞を用いた.Cに、第2暗期に入ってからの時間(横軸)に対する分裂指数(縦軸)を示す. 図9.明暗同調下の各時期のC.merolae全RNAに対するcmSAT1のノーザン(A)と、細胞の粗抽出物に対する抗SAT1抗体を用いたウェスタンブロッティング(B).それぞれ第2暗期Oh(レーン1)、4h(レーン2)、8h(レーン3)、12h(レーン4)、第3明期4h(レーン5)、8h(レーン6)にサンプリングした細胞を用いた.Cに、第2暗期に入ってからの時間(横軸)に対する分裂指数(縦軸)を示す. 図10.硫酸飢餓および略条件での細胞の粗抽出物に対する抗SAT1抗体を用いたウェスタンブロッティング.培地の硫酸濃度0mMで12h(レーン1)、24h(レーン2)、72h(レーン3)、暗条件で72h(レーン4)培養したサンプルと、通常の連続明条件(レーン5)で培養したサンプルとでは、変化が見られなかった. 図10.硫酸飢餓および略条件での細胞の粗抽出物に対する抗SAT1抗体を用いたウェスタンブロッティング.培地の硫酸濃度0mMで12h(レーン1)、24h(レーン2)、72h(レーン3)、暗条件で72h(レーン4)培養したサンプルと、通常の連続明条件(レーン5)で培養したサンプルとでは、変化が見られなかった. 図11.抗SAT1抗体を用いたC.merolae細胞の免疫電子顕微鏡写真.免疫前の抗体では、金コロイドの反応は見られなかった(A).抗SAT1抗体では金コロイドは主に葉緑体に見られた(B).比較として、抗ルビスコ抗体を用いたもの(C)をのせた、DはSpurr樹脂に埋めたC.merolae細胞の切片の電子顕微鏡像.n:核.m;ミトコンドリア.c;葉緑体.スケールバーは500nm. 図11.抗SAT1抗体を用いたC.merolae細胞の免疫電子顕微鏡写真.免疫前の抗体では、金コロイドの反応は見られなかった(A).抗SAT1抗体では金コロイドは主に葉緑体に見られた(B).比較として、抗ルビスコ抗体を用いたもの(C)をのせた、DはSpurr樹脂に埋めたC.merolae細胞の切片の電子顕微鏡像.n:核.m;ミトコンドリア.c;葉緑体.スケールバーは500nm. 表2.抗SAT1抗体、抗ルビスコ抗体、免疫前の血清を用いたときの面積( 表2.抗SAT1抗体、抗ルビスコ抗体、免疫前の血清を用いたときの面積(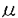 m2)あたりの金コロイド数.平均±標準偏差であらわしてある.抗SAT1抗体、抗ルビスコ抗体、免疫前の血清のサンプル数はそれぞれ16、9、12. m2)あたりの金コロイド数.平均±標準偏差であらわしてある.抗SAT1抗体、抗ルビスコ抗体、免疫前の血清のサンプル数はそれぞれ16、9、12. 図12.真正細菌におけるシステイン合成.OASTLBのみ、チオ硫酸からスルフォシステインを合成できる. 図12.真正細菌におけるシステイン合成.OASTLBのみ、チオ硫酸からスルフォシステインを合成できる. 図13.C.merolae核DNAに対するcmOASTL1.cmOASTL2、cmOASTL3、cmOASTL4のゲノミックサザン.1は、BamHI、2はEcoRI、3はEcoRV、4はHindIII、5はKpnIで切断したDNAを使用. 図13.C.merolae核DNAに対するcmOASTL1.cmOASTL2、cmOASTL3、cmOASTL4のゲノミックサザン.1は、BamHI、2はEcoRI、3はEcoRV、4はHindIII、5はKpnIで切断したDNAを使用. 図14.PFGEにより分離したC.merolae染色体DNAに対するcmOASTL1、cmOASTL2、cmOASTL3、cmOASTL4のサザン.左のレーンは、エチジウムブロマイド染色像.(左のローマ数字は染色体番号を示す.) 図14.PFGEにより分離したC.merolae染色体DNAに対するcmOASTL1、cmOASTL2、cmOASTL3、cmOASTL4のサザン.左のレーンは、エチジウムブロマイド染色像.(左のローマ数字は染色体番号を示す.) 図15.C.merolaeの2つのOASTLイソフォームの推定アミノ酸配列.報告されている大腸菌のOASTLA(cysK)(Levy and Danchin 1988)、OASTLB(cysM)(Siko et al 1990)と比較し、最下段に、全てに共通な配列を示した."-"は相同なアミノ酸を、"・"はギャップを表す. 図15.C.merolaeの2つのOASTLイソフォームの推定アミノ酸配列.報告されている大腸菌のOASTLA(cysK)(Levy and Danchin 1988)、OASTLB(cysM)(Siko et al 1990)と比較し、最下段に、全てに共通な配列を示した."-"は相同なアミノ酸を、"・"はギャップを表す. 図16.寒天培地によるOASTL1、OASTL4の相補試験.植菌後4日目の写真.NK3はASTLA、B両活性のない変異株.XL1-BlueはOASTL活性が正常なポジティプコントロール、NK3-OASTL1は増殖したが、NK3-OASTL4は増殖が見られなかった. 図16.寒天培地によるOASTL1、OASTL4の相補試験.植菌後4日目の写真.NK3はASTLA、B両活性のない変異株.XL1-BlueはOASTL活性が正常なポジティプコントロール、NK3-OASTL1は増殖したが、NK3-OASTL4は増殖が見られなかった. 図17.大腸菌の増殖曲線.横軸は、植え継ぎ後の時間(h)、縦軸は培養液の550nmでの感光度、△;NK3-OASTL1.●;NK3-OASTL4.○;JM109(ポジティプコントロール)▲;JM15(ネガティプコントロール).2回のサンプリンクの結果、NK3-OASTL1は亜硫酸をイオウ原とした最小培地(A)、チオ硫酸をイオウ原とした最小培地(B)いずれも増殖を示し、NK3-OASTL4は亜硫酸を添加した最小培地でのみ増殖が見られた. 図17.大腸菌の増殖曲線.横軸は、植え継ぎ後の時間(h)、縦軸は培養液の550nmでの感光度、△;NK3-OASTL1.●;NK3-OASTL4.○;JM109(ポジティプコントロール)▲;JM15(ネガティプコントロール).2回のサンプリンクの結果、NK3-OASTL1は亜硫酸をイオウ原とした最小培地(A)、チオ硫酸をイオウ原とした最小培地(B)いずれも増殖を示し、NK3-OASTL4は亜硫酸を添加した最小培地でのみ増殖が見られた. |