蛋白質分子の機能を解明し、分子レベルでの生体機能を理解することは分子生物学や医学だけでなく、工学の分野でも生体素子への利用という点で大きな注目を浴びている。蛋白質はよく知られているように限られた種類のアミノ酸が一次元に結合した鎖状高分子であるが、蛋白質分子の機能はアミノ酸の一次元配列で決まるのではなく、分子の三次元的な構造により支配されていることが近年明らかになってきた。すなわち、蛋白質分子の機能を理解するためにはその三次元立体構造を解明することが必要不可欠である。 現在のところ実用化されている蛋白質分子の三次元構造解析法としてはX線結晶構造解析法とNMRによる手法があり、両者は相補的に用いられている。一般にX線結晶構造解析法はNMRより高い解像度で分子構造を捉えることができるが、良質の蛋白質単結晶を必要とする。ところが蛋白質の結晶化は一般に容易ではなく、試行錯誤による結晶化条件の決定と結晶成長に多大の労力と時間を要しており、X線結晶構造解析法による分子構造決定プロセスのほとんどの時間が蛋白質結晶の作成に費やされているのが現状である。蛋白質の結晶成長が困難な理由の一つに、その結晶成長メカニズムがいまだ解明されていないという点が挙げられる。特に結晶成長の初期過程での分子集合体あるいは核形成過程については明確な知見が得られていない。結晶成長の初期過程での分子集合のメカニズムが解明されれば、ある結晶化条件が適当であるかどうかを結晶成長過程の早い段階で予測することが可能となるため、蛋白質結晶成長の初期過程は多くの研究者の興味を最近急速に集めている。本研究は、光学的手法すなわち準弾性光散乱法、動的磁気複屈折法、および光学顕微鏡を用いることにより、このような蛋白質結晶成長初期過程における分子集合のメカニズムの解明を目指したものである。本研究で用いた観察・測定手法は結晶成長過程に大きな影響を及ぼすことなく観察できるという点で、周囲の環境に非常に敏感な蛋白質結晶成長過程に対する研究手段として優れている。 本論文では、第一章で蛋白質結晶成長過程の一般的な特徴を述べ、第二章で測定手法とその原理を説明する。第三章では準弾性光散乱法による分子集合体の形成過程の観察とそれに対する考察、第四章では動的磁気複屈折法による実験結果と分子集合体内部の配列構造に関する考察、第五章では蛋白質溶液中での結晶成長と液体-液体相分離過程の競合に関する実験結果とそれに対する考察をそれぞれ述べる。 本研究では蛋白質結晶成長のモデル系として卵白リゾチームの結晶成長を選んだ。卵白リゾチームは半径約2nmの水溶性の球状蛋白質であり、蛋白質結晶成長の研究ではモデル系として最もよく使われており、その結晶化条件が詳しく調べられている。結晶化条件を変えることにより正方晶、斜方晶、針状結晶、球晶などの様々な結晶形態を持つ結晶が析出する。本研究では、結晶成長の初期過程の段階で、これらの結晶形態の違いがどのように現れるかに注目した。 準弾性光散乱法は、散乱光の揺らぎから溶液中でブラウン運動をしている粒子の並進拡散定数を測定し、流体力学的なサイズを見積もる手法である。図1は、準弾性光散乱法を用いて観察された、正方晶析出条件の溶液中に形成される分子集合体の成長の様子を示したものである。図1より、溶液中の粒径分布が時間の経過とともに二つのサイズに分離することが分かる。小さい方の分子集合体は2〜10nm、大きい方の集合体は100nm〜1 mにまで成長する。本研究ではこの二つの分子集合体を前者をユニット、後者をクラスターと呼んで区別する。ユニット、クラスターの形成・成長の結晶化条件による違いを調べたものが図2、図3である。ユニットサイズruはある時間で極大をとった後徐々に小さくなるが、この極大をとる時間は結晶化条件に強く依存する。一方クラスターの成長は結晶化条件によらずそのサイズrcが時間の1/2乗に比例して大きくなる。図4は準弾性光散乱の散乱光強度からクラスター数密度Ncを見積もったものである。クラスターが出現した後、その数密度は時間に反比例して減少していることが分かる。 mにまで成長する。本研究ではこの二つの分子集合体を前者をユニット、後者をクラスターと呼んで区別する。ユニット、クラスターの形成・成長の結晶化条件による違いを調べたものが図2、図3である。ユニットサイズruはある時間で極大をとった後徐々に小さくなるが、この極大をとる時間は結晶化条件に強く依存する。一方クラスターの成長は結晶化条件によらずそのサイズrcが時間の1/2乗に比例して大きくなる。図4は準弾性光散乱の散乱光強度からクラスター数密度Ncを見積もったものである。クラスターが出現した後、その数密度は時間に反比例して減少していることが分かる。 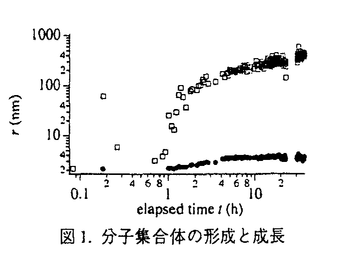 図1.分子集合体の形成と成長 図1.分子集合体の形成と成長 図2.ユニットの形成とサイズ変化 図2.ユニットの形成とサイズ変化 図3.クラスターの成長 図3.クラスターの成長 図4.クラスター数密度の変化 図4.クラスター数密度の変化 このようなクラスターサイズとクラスター数密度の時間依存性は、クラスター間の不可逆的な融合を表現した以下のようなスモルコウスキー方程式で説明できる。  ここでckはk個の分子を含むクラスター(k-mer)の数密度、Kijはi-merとj-merの反応定数である。一般にKijはiとjに依存するためこの方程式を解くのは困難だが、ブラウン運動によるクラスターどうしの衝突・融合を最も単純な形で表した場合の反応定数  を用い(Dijはi-merとj-merの相対的拡散定数、 ijはi-merとj-merの衝突の散乱断面積)、粒子数分布のスケーリング ijはi-merとj-merの衝突の散乱断面積)、粒子数分布のスケーリング を仮定すると(Nは全粒子数)、 を仮定すると(Nは全粒子数)、  が得られる。ここで〈r〉は平均クラスターサイズ、dfはクラスターのフラクタル次元、Ncは全クラスター数密度である。(3)式と図3の結果より、クラスターがフラクタル次元df〜2のランダムな分子集合体であることが分かる。このようなクラスターはコロイドが拡散律速で凝集する場合にもよく見られる。図4のクラスター数の時間依存性も(3)式とよく一致している。また、クラスターの形成・成長が結晶化条件によらないことも、クラスターがランダムな分子集合体であり、いまだ結晶としての性質を獲得していないことを示唆している。 以上のように、クラスターは結晶化条件に依存しないランダムな分子集合体と考えられるが、このような分子集合体と結晶との関係はどのようなものなのであろうか。準弾性光散乱法では結晶とみなせるような分子集合体は観察できなかった。しかし、結晶が析出しているからにはどこかで分子が規則正しく集合・配列し、成長していかなければならない。本研究では分子集合体内部の分子配列秩序を測定するために、動的磁気複屈折測定装置を開発し、リゾチームの結晶成長に適用した。 蛋白質溶液は磁場の印加に応答して複屈折を生じる。これはCotton-Mouton効果と呼ばれ、蛋白質分子が一般に光学的分極率と磁化率の異方性を合せ持つため、磁場によって配向した蛋白質分子が複屈折を生じる現象であり、このとき複屈折強度が印加磁場の二乗に比例する。このCotton-Mouton効果を利用して蛋白質溶液中の分子集合体の内部構造を調べた。結晶のように分子が配列して集合した場合には、光学的分極率と磁化率の異方性はどちらも増輻され複屈折強度が増すが、ランダムに集合した場合は分子は互いに異方性を打ち消しあって、集合体としての異方性は消失し複屈折を示さない。さらに磁により分子集合体の配向緩和を捉え、流体力学的なサイズを見積もった。図5にリゾチームの結晶成長過程に動的磁気複屈折法を適用した結果を示す。図5(a)は、複屈折信号の緩和時間を分子集合体の回転緩和時間として流体力学的サイズを見積もったものである。準弾性光散乱法で観察されたクラスターと同程度のサイズを持つ分子集合体が観察された。図5(b)は複屈折信号強度をプロットしたものである。図5(a)の分子集合体の出現と同時に複屈折強度が急激に高まっており、クラスターと同程度のサイズで結晶性を持つ分子集合体の出現と成長を示唆している。  図5.結晶性分子集合体の成長 図5.結晶性分子集合体の成長 準弾性光散乱法と動的磁気複屈折法の結果をまとめると、リゾチーム結晶成長初期過程において溶液内にはランダムな分子集合体と考えられる100nm〜1 m程度のクラスターと、2nm-10nm程度のユニットが形成される。動的磁気複屈折法の結果よりこのクラスターの内の少なくとも一部は結晶性を獲得して結晶に成長していくことが分かった。しかし、拡散律速成長により形成されたクラスター内部で分子が再配列し、結晶構造をとることが可能なのだろうか?このランダムからオーダーへの分子集合体の内部構造変化の可能性を調べるために、本研究ではリゾチーム溶液の液体-液体相分離現象と相分離後の結晶成長過程を調べた。 m程度のクラスターと、2nm-10nm程度のユニットが形成される。動的磁気複屈折法の結果よりこのクラスターの内の少なくとも一部は結晶性を獲得して結晶に成長していくことが分かった。しかし、拡散律速成長により形成されたクラスター内部で分子が再配列し、結晶構造をとることが可能なのだろうか?このランダムからオーダーへの分子集合体の内部構造変化の可能性を調べるために、本研究ではリゾチーム溶液の液体-液体相分離現象と相分離後の結晶成長過程を調べた。 リゾチーム溶液は相分離温度以下で、多数の蛋白質濃厚相のドロップレットと蛋白質希薄相とに分離する。この濃厚相ドロップレットは大きさが約10 m程度で、内部は分子間距離が1nm以下の高濃度な溶液状態であり、ランダムな分子集合体であるクラスターのモデルとして考えることができる。このドロップレットを一定温度に静置し、その変化を観察した。相分離温度以下で析出したドロップレットは、徐々に融合し、その後融合したドロップレットの一部が変化し始め、最終的には周囲のドロップレットを分解しながら球晶へと成長していく様子が観察された。すなわち濃厚相ドロップレットの一部が球晶へと変化していくことが明らかになった。この結果は、ランダムな分子集合体(クラスター)内部で分子が再配列し、結晶へと変化する可能性を示している。また、相分離濃厚相が結晶へと変化していく過程で、周囲の吸収される濃厚相が、相分離後期過程の進行と結晶成長による吸収の二つの作用の競合により様々なパターンを形成することも同時に見出した。 m程度で、内部は分子間距離が1nm以下の高濃度な溶液状態であり、ランダムな分子集合体であるクラスターのモデルとして考えることができる。このドロップレットを一定温度に静置し、その変化を観察した。相分離温度以下で析出したドロップレットは、徐々に融合し、その後融合したドロップレットの一部が変化し始め、最終的には周囲のドロップレットを分解しながら球晶へと成長していく様子が観察された。すなわち濃厚相ドロップレットの一部が球晶へと変化していくことが明らかになった。この結果は、ランダムな分子集合体(クラスター)内部で分子が再配列し、結晶へと変化する可能性を示している。また、相分離濃厚相が結晶へと変化していく過程で、周囲の吸収される濃厚相が、相分離後期過程の進行と結晶成長による吸収の二つの作用の競合により様々なパターンを形成することも同時に見出した。 蛋白質の結晶成長における結晶核の形成メカニズムは従来ほとんど分かっていなかった。本研究の準弾性光散乱法と動的磁気複屈折法による測定結果は、蛋白質結晶成長の初期過程においてまずランダムな分子集合体が結晶核形成の前段階として形成され、次にランダムな分子集合体内部の分子の再配列によって結晶へと変化・成長することを示唆している。リゾチーム溶液の液体-液体相分離によって生じた濃厚相ドロップレットからの結晶化はこの結論を支持するものである。蛋白質結晶成長初期過程における結晶核形成のメカニズムの解明は、未知の蛋白質結晶を作成する際の大きな指針となり得る。本研究を通じて、この核形成過程のメカニズムとして新しいモデルが提案されたが、これは蛋白質結晶成長の研究分野に新たな展開をもたらすことが予想される。 |