後生動物ミトコンドリアでは遺伝暗号が普遍暗号と異なっている例が多く報告されている。本研究ではその中でも例外的な遺伝暗号が見つかった尾索類マボヤにおいて変則暗号が翻訳される分子機構の解明を目指した。 後生動物ミトコンドリアでは変則暗号は次の4種類のコドンで見つかっている。コドンAUAは普遍暗号ではイソロイシン(Ile)を指定するが、棘皮、扁形、刺胞動物を除く後生動物ではメチオニン(Met)に変化し、開始コドンとしても用いられている。普遍暗号では終止コドンであるコドンUGAがすべての後生動物においてトリプトファン(Trp)となっている。コドンAAAは普遍暗号ではリジン(Lys)だが、棘皮、扁形動物ではそれがアスパラギン(Asn)である。アルギニン(Arg)に対応するコドンAGR(R:A,G)では生物の系統に従って変化しており無脊椎動物ではセリン(Ser)、脊椎動物では終止コドンである。このAGRコドンのみを翻訳するtRNAはミトコンドリアゲノム上にコードされていなく指定されるアミノ酸が変化しているのもそのためと考えられる。以前当研究室でマボヤミトコンドリアゲノム解析を行いったところ、それがグリシン(Gly)であった。また、通常コードされていないアンチコドンTCTを持つtRNA遺伝子も見つかった。一般に、コドン3字目とアンチコドン一字目はワトソン・クリック塩基対に加えてウォブル則と呼ばれる他の組み合わせの塩基対も形成する。後生動物ミトコンドリアでは限られた種類のtRNAで全てのコドンを解読するため、コドン・アンチコドン対合は、細菌や細胞質のものとは異なったウォブル則で行われていると考えられている。ミトコンドリアのウォブル則ではアンチコドンTCTは変則暗号に翻訳されるコドンAGRと対合出来ると考えられるため、このtRNAがGlyを受容しコドンAGRと対合することが予想された。本研究ではこのtRNA遺伝子から作られるtRNAの塩基配列と機能の解析を行うことにより、マボヤの変則暗号翻訳の分子機構の解明を目指した。また、マボヤではコドンAUAも他の後生動物同様にIleからMetに変化している。このtRNAに関しても同様に解析をおこなった。 1.コドンAGRを変則暗号に翻訳するtRNA 目的とするミトコンドリアtRNAを単離精製し、塩基配列をRNAレベルで解析した。tRNAは以下のようにして調製し解析した。マボヤ筋肉よりフェノール法で核酸を抽出し、陰イオン交換カラムでDNA等を取り除いたものを全tRNAとした。特定のtRNAの一部に相補的なDNAプローブを用いたノーザンプロッティング法によりtRNAが発現していることを確認した。その後固相化プローブ法を用いて目的tRNAを精製した。このtRNAはポリアクリルアミドゲル電気泳動でさらに精製しドニス・ケラー法とポストラベル法による塩基配列の解析に用いた。ノーザンプロッティング法の結果、通常コードされていないコドンAGRと対合出来ると考えられるアンチコドンTCTを持つtRNAが発現していることを確認された。また、塩基配列を解析したところこのtRNAのアンチコドン一字目は5-carboxymethylaminomethyluridine(cmnm5U)であった(図1)。同様の解析したところ同じコドンボックスに属するコドンAGY(Y:U,C)を解読するtRNASer(GCU)はアンチコドン一字目が未修飾のG、Glyに対応する普遍暗号GGN(N:U,C,A,G)を読むtRNAGly(UCC)は未修飾のUであることを確認した(図2)。ミトコンドリアのウォブル則ではアンチコドン一字目が未修飾のGではU,C(稀にはA)と、未修飾のUではU,C,A,G全てと対合する。一方、5位に修飾の入ったUではA,Gのみの制限される。マボヤではtRNA(UCU)がアンチコドン一字目の修飾によりコドンAGRにのみ対合し同じコドンボックスでコドンAGYと対合するtRNASer(GCU)と読み分けていることが示唆された。また、後生動物ミトコンドリアではtRNASer(GCU)の33位の塩基はCに保存されているがマボヤではそれがUに変化している。E.coliにおいてこの部位の塩基がCからUに変化することにより対合するコドンが制限される例が報告されており、マボヤの場合もコドンAGRのみと対合するようにtRNASer(GCU)が変化して制限している可能性も考えられる。一方、普遍暗号のGlyコドンと対合するtRNAGly(UCC)は未修飾のUをアンチコドン一字目に持つことによって、コドンGGN全てと対合するが、コドンAGRとは対合しないのでtRNAGly(UCC)がコドンAGRをGlyに翻訳することはないと考えられる。 tRNA(UCU)が受容しているアミノ酸を、当研究室開発した細胞内アミノアシルtRNAの解析法を用いて調べた。酸性条件化で調製した全アミノアシルtRNAのアミノ酸を[1-14C]無水酢酸でアセチル化し標識した。その全アセチルアミノアシルtRNAは固相化プローブ法で精製したのち薄相クロマトグラフィーで解析した。その結果tRNA(UCU)はGlyを受容していた(図4)。このことよりマボヤミトコンドリアでは、tRNA(UCU)がGlyを受容し、コドンAGRと対合することで変則的にコドンAGRをGlyに翻訳することが示唆された。一方、E.coli等の原核生物、酵母等の細胞質のGlytRNA合成酵素(GlyRS)ではアンチコドン3字目のCを認識することが報告されている。tRNAGly(UCU)ではそれがCではなくUである。普遍暗号のtRNAGly(UCC)のみを持つ牛ミトコンドリアGlyRSの粗精製画分を用いin vitroでのアミノアシル化実験を行ったところ、tRNAGly(UCC)はGlyを受容することができたが、tRNAGly(UCU)では受容活性が見られなかった(図3)。マボヤミトコンドリアでは、tRNAGly(UCU)がコドンAGRを変則的にGlyに翻訳する必要があったためにGlyRSも基質認識が変化したか、または普遍暗号のtRNAを認識するGlyRSの他に新たにtRNAGly(UCU)を認識するGlyRSがコードされるようになったと推測される。 2.コドンAURをMetに翻訳するtRNA コドンAUAは普遍暗号ではIleを指定しているが、マボヤミトコンドリアではMetを指定している。コドンAURをMetに翻訳する牛、線虫のミトコンドリアtRNAは5-ホルミルシチジン(f5C)をそのアンチコドン一字目に持つ。一方コドンAUGのみがMetを指定する棘皮動物ヒトデでは、その位置が未修飾のCであることが以前報告されている。マボヤのtRNAMet遺伝子では、アンチコドンはTATである。このtRNAがどのようにしてコドンAURと対合しているのかを調べるため以下の実験を行った。 tRNAGly(UCU)の場合と同様にtRNAMet(UAU)の単離精製と塩基配列の解析を行い、その結果、アンチコドン一字目はcmnm5Uであった(図5)。この修飾塩基はミトコンドリアのウォブル則ではA、Gと対合することができる。コドンAURがMetに翻訳されていることはこのウォブル則と矛盾せず、アンチコドン一字目の修飾塩基によって変則暗号に翻訳されると推測される。また、tRNAMet(UAU)がタンパク質合成系で機能していることを確かめるために、マボヤミトコンドリアの抽出液を用いてin vitroでのMetの受容活性を調べ、このtRNAがMetを受容することが示された(図5)。一方アンチコドンがf5CAUであるウシのミトコンドリア抽出液と牛ミトコンドリアtRNAMetを用いて、マボヤミトコンドリア抽出液とtRNAMetとの交換実験を行ったところ、マボヤのミトコンドリア抽出液では両方のtRNAがMet受容活性を示したが、牛のミトコンドリア抽出液では牛のtRNAのみがMetを受容した(図5)。通常tRNAMetのアンチコドンは広く保存されており、これはミトコンドリアでも同じである。E.coliではこのアンチコドンがメチオニルtRNA合成酵素(MetRS)の基質認識を決める部位であることが報告されている。軟体動物二枚貝(Mytilus edulis)ではアンチコドンCATとTATを持つ2種類のtRNAMet遺伝子が報告されてが、マボヤではアンチコドンがTATのtRNAMet遺伝子のみがDNA上に存在している。この事実は、アンチコドンが変化したことに伴い、一般に核にコードされているMetRSも変化したことを示唆している。 発表状況 1)A Kondo,S Yokobori,T Ueda and K Watanabe(1996)"Primary sequence of ascidian mitochondrial glycine tRNA translating non-universal codons AGR(R:A,G)"Nucleic Acid Symposium Series No.35,279-280 2)A Kondow,S Yokobori,T Ueda and K Watanabe"Ascidian mitochondrial tRNAMet possessing unique structural characteristics"Nucleosides and Nucleotides No.17(1-3),531-539 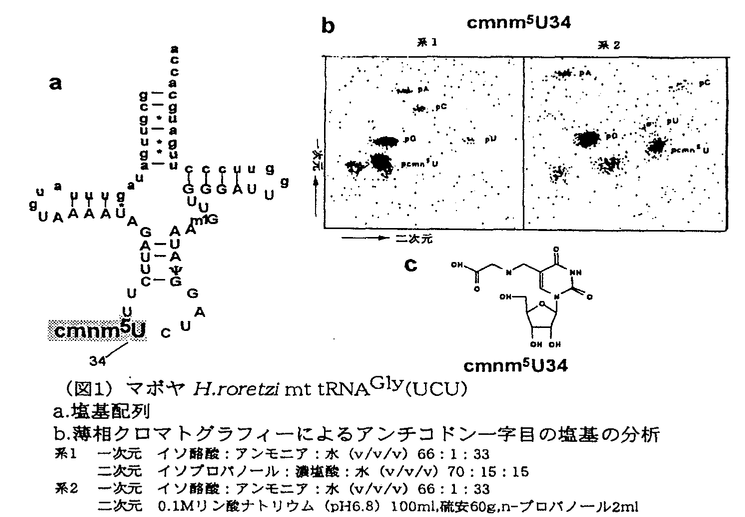 (図1)マボヤH.roretzi mt tRNAGly(UCU)a.塩基配列 b.薄相クロマトグラフィーによるアンチコドン一字目の塩基の分析 系1 一次元 イソ酪酸:アンモニア:水(v/v/v)66:1:33 二次元 イソプロパノール:濃塩酸:水(v/v/v)70:15:15 系2 一次元 イソ酪酸:アンモニア:水(v/v/v)66:1:33 二次元 0.1Mリン酸ナトリウム(pH6.8)100ml,硫安60g,n-プロパノール2ml c.cmnm5Uの構造 (図1)マボヤH.roretzi mt tRNAGly(UCU)a.塩基配列 b.薄相クロマトグラフィーによるアンチコドン一字目の塩基の分析 系1 一次元 イソ酪酸:アンモニア:水(v/v/v)66:1:33 二次元 イソプロパノール:濃塩酸:水(v/v/v)70:15:15 系2 一次元 イソ酪酸:アンモニア:水(v/v/v)66:1:33 二次元 0.1Mリン酸ナトリウム(pH6.8)100ml,硫安60g,n-プロパノール2ml c.cmnm5Uの構造 (図2)マボヤH.roretzi mt tRNAGly(UCU)tRNAGly(GCU)の塩基配列 (図2)マボヤH.roretzi mt tRNAGly(UCU)tRNAGly(GCU)の塩基配列 (図3)mt tRNAGlyのin vitroアミノアシル化標準的な反応液組成を以下に示す100mM Tris HCl(pH8.0) 15mM MgCl2 2mM ATP 20mM KCl 0.2mM spermine 0.4 (図3)mt tRNAGlyのin vitroアミノアシル化標準的な反応液組成を以下に示す100mM Tris HCl(pH8.0) 15mM MgCl2 2mM ATP 20mM KCl 0.2mM spermine 0.4 M mt tRNAGly 38 M mt tRNAGly 38 M[14C]Gly(3.81GBq/mmol)1/10vol.mitochondrial extract M[14C]Gly(3.81GBq/mmol)1/10vol.mitochondrial extract (図4)細胞内アミノアシルtRNA(UCU)の解析展開溶媒:n-ブチルアルコール:酢酸:水(v/v/v)4:0.9:1 (図4)細胞内アミノアシルtRNA(UCU)の解析展開溶媒:n-ブチルアルコール:酢酸:水(v/v/v)4:0.9:1 (図5)マボヤH.roretzi mt tRNAMet(UAU)の塩基配列(左図)とアンチコドン一字目の塩基の分析 (図5)マボヤH.roretzi mt tRNAMet(UAU)の塩基配列(左図)とアンチコドン一字目の塩基の分析 (図6)mt tRNAMetのin vitroでのアミノアシル化 (図6)mt tRNAMetのin vitroでのアミノアシル化 |