| [序] 蛋白質の生合成の研究は、生物全般にまたがる基礎研究として近代科学において中心的役割を担ってきた。蛋白質生合成における高度の分子認識やRNAの新しい機能に関しての研究は、他の分野でのさまざまな分子機構を解明するための先駆的な役割を果たしてきており、今後も生物の発生、分化をはじめ細胞の癌化など多くの生物現象の解明にいっそう重要性を加えるとおもわれる。また最近、遺伝子操作の急速な進歩に伴って蛋白質の生産という応用面においても各方面から注目されるにいたっている。本研究は、そのような研究の状勢をふまえて、哺乳類ミトコンドリアの蛋白質合成系に着目している。 ミトコンドリアは真核生物において酸化的リン酸化により生命活動のエネルギー源であるATPを合成しているオルガネラである。ミトコンドリアは核とは別に独自のDNAを有し、このDNAにコードされた蛋白質を合成するための独自の蛋白質合成系をもつことが知られている。ミトコンドリアの蛋白質合成系は原核生物のものに近いと考えられている。これはミトコンドリアでfMet-tRNAが開始反応に用いられることや、リボソームの抗生物質耐性の性質が原核生物のものに類似していること、ミトコンドリアの伸長因子が原核生物のリボソーム上で機能しうることなどにもとづいている。しかしながら、動物ミトコンドリアの翻訳機構は幾つかの点で他の翻訳系とは異なるユニークな特徴をもっている。具体的には、普遍暗号とは異なるコドンの使用や通常のクローバ葉型構造とは異なった異常高次構造を持つtRNAの存在、mRNAの先導配列がないことなどである。これらはこれまで細菌や細胞質の系で明らかにされた遺伝子発現系とは異なった未知のメカニズムの存在を示唆するものである。 原則からはずれた対象を研究することは、蛋白質合成のような全生物に共通な反応の分子機構を解明するためのひとつの有効な手段であり、新たな視点と解釈の提示が期待できる。本研究では、いまだその殆どが未解明であるミトコンドリアの蛋白質合成系のメカニズムを明らかにするため、まず以下に述べる哺乳類ミトコンドリアの翻訳開始機構における問題点に着目した。その問題をとくために鍵となる役割を果たしているMetionyl-tRNA transformylase(MTFmt)に焦点をしぼり、その基質特異性の解析を行った。 哺乳類ミトコンドリアの翻訳開始機構における問題点とMTFmt 蛋白質の生合成は、開始methionyl-tRNAがリボソームのPサイトに結合して開始される。この過程は、原核生物では開始因子IF-2、真核生物ではeIF-2によって促進される。一方、その他の全てのアミノアシル-tRNA(aa-tRNA)は伸長用のtRNAとして機能し、リボソームのAサイトに結合する。これは原核生物では伸長因子EF-Tu、真核生物ではeEF-1によって促進される。ほとんど全ての生物は開始tRNAをもち、これは開始反応に選択的に使用されるための特徴的な構造をもつ。 原核生物と真核生物のオルガネラ(ミトコンドリアやクロロプラスト)では、開始Met-tRNAはMethionyl-tRNA transformylase(MTF)によってホルミル化をうける。大腸菌のMTFは、開始tRNAの特徴的な構造を認識して、開始と伸長のtRNAを厳密に区別する。Met-tRNAがホルミル化をうけると、IF-2との親和性が増し、EF-Tuとの相互作用が阻害されて、開始反応に用いられる。この過程における、ホルミル化の重要性は、MTF遺伝子を欠損した大腸菌が通常通り生育できないことによっても示されている。 酵母や植物では、開始tRNAはホルミル化をうけないが2’-O-ribosyl phosphateという修飾塩基を64位にもっている。これにより伸長因子との相互作用が阻害され、そして有利にeIF-2により選択的にリボソームのPサイトに結合させられ、開始反応に用いられるようになっている。 哺乳類ミトコンドリアには、メチオニンのtRNAは1種類しかなく、また細胞質からの移入もないとされている。哺乳類ミトコンドリアの翻訳の開始ではfMet-tRNAが用いられ、これはIF-2mtによってリボソームに結合させられることが分かっている。またMet-tRNAはEF-Tumtによって伸長反応に利用されることが明らかになっている。したがって、一つのメチオニンtRNAからfMet-tRNAとMet-tRNAの2種が生じ、開始と伸長の機能をはたしていると考えられる。哺乳類ミトコンドリアでは開始反応に特異的にもちいられる開始tRNAという分子種は存在しない。 哺乳類ミトコンドリアの翻訳開始では、どのようにしてMet-tRNAがあらゆるaa-tRNAの中からMTFmtによって選択されているのか不明である。またどのようにしてある割合のMet-tRNAのみがホルミル化を受けて開始tRNAとして機能するようになるのかも問題である。 [実験と結果] 1)MTFmtの精製と部分ペプチド配列の決定 MTFmtは牛ミトコンドリアからカラムクロマトグラフィーを用いておよそ25%の精度に部分精製された(Table.I)。60gのミトコンドリアよりおよそ2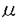 gのMTFmtが得られる。このサンプルについて、SDSポリアクリルアミド電気泳動を行って目的の蛋白質バンドを切り出し、Edmann法により部分ペプチド配列を決定した(Table II)。 gのMTFmtが得られる。このサンプルについて、SDSポリアクリルアミド電気泳動を行って目的の蛋白質バンドを切り出し、Edmann法により部分ペプチド配列を決定した(Table II)。 2)MTFmtのcDNAのクローニング MTFmt遺伝子は、ウシ心臓cDNAライブラリーからスクリーニングを行って得た(Fig.1)。成熟MTFmtは357アミノ酸残基で、大腸菌および酵母のMTFとおよそ30%の相同性がみられた。 3)MTFmtの大量発現系の構築 MTFmtはそのN末端にHistidine-tagをつけた融合蛋白質として大腸菌内で発現させた。この組み換えMTFmtはニッケルカラムを用いて単一に精製され、収量は1Lの培地あたりおよそ4mgであった(Fig.2)。 4)MTFmtの基質特異性の解析 はじめに三種類の基質(ミトコンドリアのmethionyl-tRNAおよび大腸菌の開始methionyl-tRNAと伸長methionyl-tRNA)に対して速度定数を決定した(Table III)。MTFmtは、MTFmtは同一種内の基質であるミトコンドリアのmethionyl-tRNAとばかりでなく大腸菌の開始methionyl-tRNAを同様の効率でホルミル化した。大腸菌のMTFは、開始と伸長tRNAを明確に区別するため伸長methionyl-tRNAは決してホルミル化しないことが明らかにされている。驚いたことにMTFmtは、低いレベルではあるが大腸菌の伸長methionyl-tRNAも有意にホルミル化した。 次に、大腸菌のメチオニンtRNAの様々な変異tRNAを用いて、MTFmtのtRNAの認識部位を調べた(Table IV)。尚、大腸菌のMTFの基質認識には開始tRNAのアクセプターステムの構造が重要であり、特に1;72位のミスマッチが重要であることが知られている。 1;72位に強い塩基対を導入した変異体に対するMTFmtのKcat/Kmは、いづれも野生型開始tRNAの10分の1ほどに低下した。また、Discriminator塩基の変異体も3分の1程に低下した。しかし、伸長tRNAに開始tRNAのアクセプターステムを導入した変異tRNAのKcat/Kmは、野生型伸長tRNAとほぼ同等の値を示し、開始tRNAのアクセプターステムはあまり重要ではないことが示された。 伸長tRNAに開始tRNAのアンチコドンステムを導入した変異tRNAも、野生型伸長tRNAとほぼ同等の値を示したことから、この部位も重要でないことが明らかとなった。 これらの結果から、MTFmtの基質認識にはD-stemあるいはT-stemが重要である可能性が残された。しかし、開始tRNAの1.72位や73位の変異体が野生型開始tRNAよりやや悪い基質であることから、アクセプターステム中のこの部位も、何らかの形でMTFmtによる認識に関与していることが示唆された。MTFmtの基質特異性は、大腸菌のMTFと異なることが示唆された。 [MTFmtのホルミル化反応機構に関する考察] 最近、大腸菌MTFとfMet-tRNAの複合体の構造がX線結晶解析により決定された。大腸菌MTFでは、N末ドメインのLooplがtRNAのアクセプターステムに入り込み、アクセプターステムがほどかれる。そして3’端に結合したメチオニングループがホルミル化の触媒活性部位にくることができて反応が進む(Fig.3)。MTFはあらゆる種類のtRNAに対して親和性をもつが、1;72位のCAミスマッチのためにほどかれやすいアクセプターステムをもつ開始tRNAだけが、大腸菌のMTFの基質となることができる。大腸菌MTFにおいては、Looplが柔らかいtRNAのアクセプターステムを選択し、MTFの基質特異性を決定している。 哺乳類ミトコンドリアのMTFmtは、伸長tRNAもホルミル化できることから、その反応においてアクセプターステムをほどく必要がない可能性が推察される。 大腸菌MTFのLooplとtRNAのアクセプターステムの相互作用には、Loopl中に豊富に存在する塩基性のアミノ酸残基が重要であると考えられている。様々な生物種のMTFのLooplの領域を比較すると(Fig.4)、MTFmtのLooplだけにはそのような塩基性のアミノ酸残基があまりみとめられない。従ってミトコンドリアMTFのLooplはアクセプターステムに親和性をもたないことが考えられる。あるいは、Loopl中のアミノ酸配列の保存性に着目すると、むしろMTFmtにはLooplが殆ど存在しない可能性も考えられる。 Looplがない、あるいは、Looplがアクセプターステムに親和性をもたないために、固いアクセプターステムをもつ伸長Met-tRNAのメチオニングループも、Looplに邪魔されることなく、容易に触媒活性部位にくることができるのかもしれない。MTFmtではlooplの代わりに、他の領域がが基質特異性を支配し、従ってtRNAのアクセプターステムとは異なる領域を認識しているのであろう(Fig.3)。Looplを欠損させた変異型大腸菌MTFは、開始、伸長tRNAを区別せずにホルミル化することが明らかになっており、このモデルを説明することができる。 大腸菌MTFとfMet-tRNAの複合体の結晶構造から、tRNAのDステムはMTFと接触していることが示されており、また生化学的な実験からも大腸菌MTFはDステム中の11・24位を認識していることが知られている。また、MTFmtは酵母の細胞質の開始tRNAをあまりホルミル化できないことが分かっている。酵母の開始tRNAには、細菌型の開始tRNAに特徴的にみられるDステム中の11・24のプリン、ピリミジン塩基対がみられない。今回の基質特異性の解析から、MTFmtはtRNAのDステムを認識している可能性が残された。Dステムの11・24位は、MTFmtの強い認識部位である可能性が強いと考えている。 また、ミトコンドリアMTFmtが、1.72位の塩基対やdiscriminator塩基に変異を加えたtRNAをあまりホルミル化しないことから、Looplは、基質特異性の決定にはさほど重要ではないものの、やはりアクセプターステムに接触している可能性がある。例えば、Looplはdiscriminator、1、72で囲まれる形でアクセプターステムに接触し、メチオニングループを触媒活性部位に添えるような働きをしているのかもしれない(Fig.3)。 いずれにせよ、MTFmtが開始と伸長tRNAを厳密に区別せず、そして細菌の開始tRNAの特徴的構造であるアクセプターステムをあまり認識しない、という結果は、動物ミトコンドリアのメチオニンtRNAが1種で、開始tRNAが存在しないことと相入れるものである。MTFmtは進化の過程で、その認識部位を、開始tRNAに特徴的なアクセプターステムから別の領域へと、変化させてきたのかもしれない。 [今後の課題] 哺乳類ミトコンドリアの翻訳開始機構において、Met-tRNAのみがどのようにMTFmtに選択されるのか明らかにするため、引き続き変異tRNAを用いてMTFmtの反応機構を解析する。また、蛋白質への変異導入、X線結晶構造解析といった手法と併せて解析を進める予定である。 [本研究の意義] 原核生物や真核生物の細胞質の蛋白質合成系の研究が生化学的な手法により発展してきたのに対し、微量で不安定な哺乳類ミトコンドリアの翻訳因子は調製が難しく、その研究がはばまれてきた面が大きい。近年になって、いくつかの哺乳類ミトコンドリアの翻訳因子(IF-2mt,EF-Tumt,EF-Tsmt,EF-Gmt,PheRSmt;当研究室と共同研究を行っているSpremulliらによる、SerRSmt;当研究室による)が精製され、cDNAのクローニングおよび大量発現系を構築するにいたっている。本研究を含むこうした一連の研究成果により、ミトコンドリアの蛋白質合成系の研究もようやく可能な段階にはいったといえるだろう。酵母ミトコンドリアの蛋白質合成系の研究は、遺伝子操作の技術を駆使して飛躍的に発展してきたが、動物細胞においてもその技術が適用されつつある。動物ミトコンドリアの蛋白質合成系において中心的な役割をになう翻訳因子のcDNAクローニングは、そうしたアプローチへも大きく貢献することが期待される。 [発表論文] 1)N.Takeuchi,M.Kawakami1,C.Takemoto,T.Ueda,L.L.Spremulli,K.Watanabe(1997)"Mitochondrial methionyl-tRNA transformylase from bovine liver" Nucleic Acids Symposium series37,195-196 2)N.Takeuchi,M.Kawakami,A.Omori,T.Ueda,L.L.Spremulli,and K.Watanabe(1998)"Mammalian Mitochondrial Methionyl-tRNA Transformylase from Bovine Liver:Purification,Characterization and Gene Structure"J.Biol.Chem.273,15085-15090 3)N.Takeuchi,T.Ueda and K.Watanabe(1998)"Expression and Characterization of Bovine Mitochondrial Methionyl-tRNA transformylase"J.Biochem.(in press)  Table I.MTFmtの精製表 Table I.MTFmtの精製表 Table II.MTFmtの部分ペプチド配列 N末のアミノ酸配列(1)および2つの内部ペプチド配列(2,3)を示す。遺伝子から推定されるアミノ酸配列における位置はペプチド配列の右に示す。 Table II.MTFmtの部分ペプチド配列 N末のアミノ酸配列(1)および2つの内部ペプチド配列(2,3)を示す。遺伝子から推定されるアミノ酸配列における位置はペプチド配列の右に示す。 fig.1 MTFmtのcDNA配列とアミノ酸配列アミノ酸配列の番号は、成熟型MTFmtのN末端のアミノ酸を1としている。下線は推定されるポリアチニレーションシグナル配列を示す。(a)nはpoly(A)を示す。 fig.1 MTFmtのcDNA配列とアミノ酸配列アミノ酸配列の番号は、成熟型MTFmtのN末端のアミノ酸を1としている。下線は推定されるポリアチニレーションシグナル配列を示す。(a)nはpoly(A)を示す。 fig.2 SDS-PAGEによる組み換え MTFmtの解析Lane1:分子量マーカー,Phosphontase B(102,000)Serum bovine(81,000).evalbumh(46,900).corbonk anhudrase(32,700)and Soybean inhlbloy(30,200)Lane2:細胞抽出液(S・100)Lane:3Niカラムによる細胞質の組み換えMTFml Lane4:ThombthでHis-logを除去した組み換えMTFml Lane5:NiカラムによりHis-log付組み換えMTFmlから分解されたMTFml fig.2 SDS-PAGEによる組み換え MTFmtの解析Lane1:分子量マーカー,Phosphontase B(102,000)Serum bovine(81,000).evalbumh(46,900).corbonk anhudrase(32,700)and Soybean inhlbloy(30,200)Lane2:細胞抽出液(S・100)Lane:3Niカラムによる細胞質の組み換えMTFml Lane4:ThombthでHis-logを除去した組み換えMTFml Lane5:NiカラムによりHis-log付組み換えMTFmlから分解されたMTFml Table III.MTFmtによる大腸菌伸長Met-tRNAのホルミル化反応は10mM KCL、5mM MgCl2、0.5%CHAPS、pH7.6、30℃。アミノアシル化との非カップル系で行った。組み換えMTFmtの速度定数を斜体で示す。 Table III.MTFmtによる大腸菌伸長Met-tRNAのホルミル化反応は10mM KCL、5mM MgCl2、0.5%CHAPS、pH7.6、30℃。アミノアシル化との非カップル系で行った。組み換えMTFmtの速度定数を斜体で示す。 Table IV.組み換えMTFmtによるtRNAの認識反応は150mM KCL、7mM MgCl2、pH7.6、25℃、アミノアシル化とのカップル系で行った。 Table IV.組み換えMTFmtによるtRNAの認識反応は150mM KCL、7mM MgCl2、pH7.6、25℃、アミノアシル化とのカップル系で行った。 fig.3 MTFのモデル図E cot MTFでは、Looplによってアクセプターステムがほどかれなければ、メチオニン残基は触媒活性部位に届かない。ミトコンドリアMTFmtのLooplは、著しく短い、あるいはアクセプターステムへの親和性が低い可能性がある。Looplによる障害がないため、その反応にアクセプターステムをほどく必要がないかもしれない。 fig.3 MTFのモデル図E cot MTFでは、Looplによってアクセプターステムがほどかれなければ、メチオニン残基は触媒活性部位に届かない。ミトコンドリアMTFmtのLooplは、著しく短い、あるいはアクセプターステムへの親和性が低い可能性がある。Looplによる障害がないため、その反応にアクセプターステムをほどく必要がないかもしれない。 fig.4 様々な生物種のMTFのLooplに相等する領域の比較Looplに豊富に存在する塩基性のアミノ酸残基は、tRNAのアクセプターステムとの相互作用に重要だとされている。MTFmtのLooplに相等する領域には、そのような塩基性のアミノ酸残基があまりみとめられない。また、アミノ酸配列の保存性に着目してみると、MTFmtにはLooplが存在していない可能性も考えられる。 fig.4 様々な生物種のMTFのLooplに相等する領域の比較Looplに豊富に存在する塩基性のアミノ酸残基は、tRNAのアクセプターステムとの相互作用に重要だとされている。MTFmtのLooplに相等する領域には、そのような塩基性のアミノ酸残基があまりみとめられない。また、アミノ酸配列の保存性に着目してみると、MTFmtにはLooplが存在していない可能性も考えられる。 |