学位論文要旨
| No | 114369 | |
| 著者(漢字) | 井上,宗宣 | |
| 著者(英字) | ||
| 著者(カナ) | イノウエ,ムネノリ | |
| 標題(和) | 光学活性ジャスモン酸類の合成研究 | |
| 標題(洋) | ||
| 報告番号 | 114369 | |
| 報告番号 | 甲14369 | |
| 学位授与日 | 1999.03.29 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(農学) | |
| 学位記番号 | 博農第1977号 | |
| 研究科 | 農学生命科学研究科 | |
| 専攻 | 応用生命化学専攻 | |
| 論文審査委員 | ||
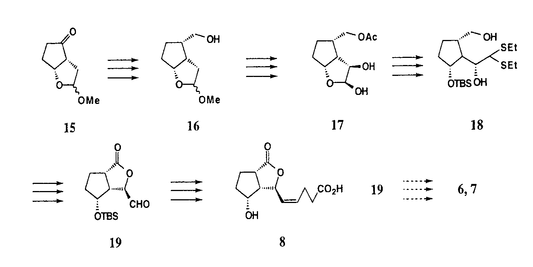
| 内容要旨 | ジャスモン酸類は、ジャスミンや蘭といった植物の主要香気成分として単離された化合物である。様々な合成ルートが開発され、工業的にも香料として実用化されている。しかしながら、近年の生理機能研究の結果、ジャスモン酸類には生長抑制、老化促進、塊茎形成誘導活性、傷害応答のシグナル伝達といった様々な生理活性を持っていることがわかり、新たな植物ホルモンとして考えられつつある化合物である。しかし、その作用機作や構造活性相関など依然不明な点も多く、また活性発現にはジャスモン酸の持つ立体化学が重要と考えられている。多くのジャスモン酸合成ルートが開発されているが、光学活性なジャスモン酸の合成ルートは少数しかなく、様々な誘導体合成に適した簡便な方法は少ない。そこで、ジャスモン酸の誘導体合成が可能な合成ルートの開発、生理活性試験への試料の供与を目的として、種々の光学活性なジャスモン酸類の合成研究を行った。 Methyl cis-(Z)-dehydrojasmonate1は、中国、台湾、日本南部に生育する東洋蘭(Cymbidium goeringii)の主要香気成分として、スイスGivaudan社のR.Kaiser博士により単離構造決定された化合物である。しかし、単離された天然物は微量であり、その絶対立体配置は決定されていない。そこで、その両鏡像体を合成しその絶対立体配置の決定を行うため、また生理活性試験に試料を供するため合成を開始した。 ジチアン10は、容易に高光学純度(>99.6%e.e.)で両鏡像体が大量入手可能なプロスタグランジン合成の中間体である、ジクロロラクトン(+)-9より既知のルートで10段階で導ける。10のジチアン部分をHg塩により加水分解後、Selenyl Wittig反応によりシスのオレフィンを導入し、過酸化水素によるセレニドの酸化的脱離によりジエン11を合成した。ラクトン部分を加水分解、CH2N2によるエステル化後、Dess-Martin酸化によりケトンの 絶対立体配置の決定は、キラルなカラムを固定相に用いたガスクロマトグラフィーにより(+)-1,(-)-1の retention indexを計測して、天然物の同条件下で測定したretention indexと比較することにより、(+)-1が天然体であると決定した。又、塊茎誘導活性試験を行い天然体(+)-1の方が、非天然体(-)-1より活性が高いことがわかった。  -D-glucopyranosyltuberonate2及び、そのepi体3の合成 -D-glucopyranosyltuberonate2及び、そのepi体3の合成 Methyl 合成には、1の合成中間体であるジチアン10を用いた。加水分解後、Wittig反応を経て6段階でアルコール12を得た。Konigs-Knorr反応により糖とのカップリングを行い選択的に エピ体3の合成は以下のように行った。合成の最終段階において糖の保護基の脱保護をケトンの Methyl tuberonate4は、香田らにより馬鈴薯(Solanum tuberosum L.)の葉から単離された塊茎形成誘導物質tuberonic acidのメチルエステル体である。また、Jasmine ketolactone5は、Navesらによってイタリアンジャスミン(Jasminum grandiflorum L.)の精油成分として単離された化合物である。両化合物は当研究室において両鏡像体が合成されているが、収率、最終物のジアステレオ純度に問題がある合成であった。そこで、それらを解決すべく改良合成を行うこととした。 Methyl tuberonate4の合成には、グリゴシド2の合成中間体であるアルコール12を用いた。4の一級水酸基の保護基は、3の合成と同様に合成の最終段階において中性条件によって脱保護しなくてはならない。3の合成と同様にハロアセチル基の条件の検討を行った所、トリフルオロアセチル基で良い結果を与えた。12の水酸基をトリフルオロアセチル基で保護し、脱TBS基、酸化によりケトン13を得ることができた。最後の保護基の脱保護は、MeOH中で無触媒で室温で撹拌することで異性化を伴わず脱保護が進行し、目的とする(+)-Methyl tuberonate4を得ることができた(12より4段階43%)。同様に、その鏡像体(-)-4の合成も行った。 Jasmine ketolactone5の合成もアルコール12より行った。エステル部分をアルカリ加水分解しヒドロキシ酸とし、山口法(2,4,6-trichlorobenzoyl chrolide、Et3N,DMAP)を用いることでマクロラクトン化を行い10員環ラクトンを得た。脱TBS基、Dess-Martin酸化によりケトンの Bacillariolide I(6), II(7),III(8)は、ロードアイランド大学の清水らにより珪藻(Pseudo-nitzchia multiseries)およびその培養液より単離された化合物である。活性については、Bacillariolide IがホスホリパーゼA2の阻害活性があると報告されているだけである。構造的にシクロペンタン環にシスの二重結合、カルボニル基を持つ側鎖がある点でジャスモン酸類と構造が類似しており、活性についてもジャスモン酸同様の活性が期待できる。これらのことを明らかにするために合成を開始した。 合成の出発原料としてケトン15を用いた。この化合物は、ジャスモン酸合成における9から10への合成を行うときの中間体である。Wittig反応により、一炭素増炭し、水ホウ素化反応、続く酸化的処理によりアルコール16を得た。水酸基のアセチル保護、続く四段階の反応によってアセタールの 現在、アルデヒド19とのWittig反応によりテトラエンを導入し、Bacillariolide I(6)、II(7)への変換を検討中である。 また、化合物2,3,4,5とあわせて種々の生理活性試験へ供与する予定である。 | |
| 審査要旨 | 本研究は、最近植物ホルモンとして注目されている種々のジャスモン酸類のエナンチオおよび、ジアステレオ選択的な合成に関するものであり4章からなる。
1は、東洋蘭(Cymbidium goeringii)の主要香気成分として、Kaiserにより構造決定された化合物である。しかし,その絶対立体配置は決定されていない。そこで、両鏡像体を合成しその絶対立体配置の決定を行った。 高光学純度の(+)-9より10段階で導ける10を出発原料として用いた。ジチアン部分の加水分解後、Wittig反応等でシスのオレフィンを導入し、11を合成した。加水分解、エステル化後、Dess-Martin酸化によりケトンの
キラルなカラムを固定相に用いたガスクロマトグラフィーにより(+)-1, (-)-1、天然物のretention indexを計測して、(+)-1が天然体であると決定した。又、塊茎誘導活性試験を行い(+)-1の方が、(-)-1より活性が高いことがわかった。  -D-glucopyranosyloxyjasmonate2およびMethyl -D-glucopyranosyloxyjasmonate2およびMethyl  -D-glucopyranosyltuberonate3の合成 -D-glucopyranosyltuberonate3の合成2は、幸田らによってキクイモ(Helianthus tuberosus L.)の葉から単離された塊茎形成誘導活性物質である。また、エピ体3はカルボン酸の形で馬鈴薯(Solanum tuberosum L.)より単離された化合物である。 10を出発原料として、6段階でアルコール12を得た。Konigs-Knorr反応により選択的に
4は、幸田らにより馬鈴薯(Solanum tuberosum L.)の葉から単離された塊茎形成誘導物質tuberonic acidのメチルエステル体である。また、5は、イタリアンジャスミン(Jasminum grandiflorum L.)の精油成分として単離された化合物である。両化合物は当研究室において両鏡像体が合成されているが、収率、最終物のジアステレオ純度に問題がある合成であったので、改良合成を行った。 4の合成は、12を出発原料として用いた。4の一級水酸基の保護基は、3の合成と同様に合成の最終段階において中性条件によって脱保護しなくてはならない。12の水酸基をトリフルオロアセチル基で保護後、ケトン13を得ることができた。最後の保護基の脱保護は、MeOH中で無触媒で撹拌することで異性化を伴わず脱保護が進行し、(+)-Methyl tuberonate4を得ることができた(12より4段階43%)。同様に、(-)-4の合成も行った。 5の合成も12より行った。加水分解でヒドロキシ酸として、山口法を用いてマクロラクトン化を行い10員環ラクトンを得た。二段階後、14を得て、DBUで異性化を行わさせ、(-)-Jasmineketolactone5を高収率で得ることができた(12より5段階、51%)。同様にその鏡像体(+)-5の合成も行った。以上のような改良合成行い、4及び5を高収率、高ジアステレオ選択的に合成する事ができた。
Bacillariolide I(6),II(7),III(8)は、珪藻(Psseudo-nitzchia multiseries)より単離された化合物である。ジャスモン酸類と構造が類似しており、ジャスモン酸同様の活性が期待できる。これらのことを明らかにするために合成研究を行った。 出発原料として9より導けるケトン15を用いた。増炭反応等でアルコール16を得て、続く五段階の反応によってアセタールの
以上、本論文では植物ホルモンとして注目されているジャスモン酸類の合成研究を行い、エナンチオ選択的合成経路を確立した。これは、有機合成化学分野において学術上貢献するところが多く、また農学分野における実用的な応用も期待できる。よって審査委員一同は、本論文が博士(農学)の学位論文として価値のあるものと認めた。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/54704 |

 位の異性化を伴うことなく、目的物の(+)-Methyl cis-(Z)-dehydrojasmonate1の合成に成功した(10より6段階、49%)。同様に鏡像体(-)-9を出発原料として鏡像体(-)-1の合成も行った。
位の異性化を伴うことなく、目的物の(+)-Methyl cis-(Z)-dehydrojasmonate1の合成に成功した(10より6段階、49%)。同様に鏡像体(-)-9を出発原料として鏡像体(-)-1の合成も行った。