現在糖の構造解析はHPLCを用いるものが普及しているが、前処理に問題があり簡便とは言いがたい。それらの背景をふまえ新たにキャピラリー電気泳動(CE)を用いたより簡便迅速な糖分析法ならびに糖鎖解析法の開発を目的として検討を行った。さらに糖の構造と電気泳動現象の関係についても考察を行った。 糖は蛍光や紫外吸収を持たないため、その検出には吸収を持つ誘導体化が必要である。本研究では蛍光を持ち、紫外吸収も比較的強い2-アミノ安息香酸に着目し、反応の最適条件を検討した。その結果、0.2M2-アミノ安息香酸、還元剤として1.0MNaBH3CN、溶媒には水を用いるきわめて簡単な系で効率の良い標識ができた。反応時間は、65℃では4時間、40℃では16時間が良いということが示された。 キャピラリー電気泳動を用いて糖タンパク質の単糖組成分析法を開発した。印加電圧20kV、泳動液にpH7.0の150mMホウ酸、50mMリン酸ナトリウム溶液を用いることにより、糖タンパク質に通常含まれている糖、GalN,GlcN,Rib,Fuc,Man,Gal,およびGlcを10分程度で完全に分析することができた。UV214nmの検出で検量線は10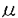 Mから500 Mから500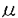 Mの範囲で直線性を示し、検出限界は濃度感度でnMオーダー、絶対量ではfmolオーダーであった。糖タンパク質フェツインを分析したところ本法から得られた結果は報告値と一致し、単糖組成分析において有効であることが示された。本法は現在普及している2-アミノピリジン誘導体のHPLC分析方より分析時間が十分の一程度と迅速であること、前処理や操作の点で断然優れていること、さらに従来法より定量の高い信頼性を持つ点に大きな特長があった。 Mの範囲で直線性を示し、検出限界は濃度感度でnMオーダー、絶対量ではfmolオーダーであった。糖タンパク質フェツインを分析したところ本法から得られた結果は報告値と一致し、単糖組成分析において有効であることが示された。本法は現在普及している2-アミノピリジン誘導体のHPLC分析方より分析時間が十分の一程度と迅速であること、前処理や操作の点で断然優れていること、さらに従来法より定量の高い信頼性を持つ点に大きな特長があった。 キャピラリー電気泳動を用いてグリコサミノグリカンの分析法を開発した。印加電圧20kV、泳動液にpH8.2の150mMホウ酸、25mMリン酸ナトリウム溶液を用いることにより、コンドロイチン硫酸の構成二糖、合計9種の二糖を完全に分離することができた。 糖鎖分析は今までの単糖や二糖類の分析と同じ泳動液では溶出が早すぎ分析には不適当である。そこで、泳動液にPEGを加えたモード、ホウ酸溶液を用いたモード、低pHの泳動液を用いるモードで分離する方法を検討した。泳動液にPEGを加えたモードおよびホウ酸溶液を用いたモードは、グルコースオリゴマーの分離、コンプレックス型N-グリカンの分離はともに良好であった。低pHモードでは、分析時間が長く糖鎖分析には不適当であった。以上から泳動液にPEGを加えたモードおよびホウ酸溶液を用いたモードでは分離は良好であったので、糖タンパク質の糖鎖分析への応用の可能性が示された。 キャピラリー電気泳動において分圧は分子の電荷とストークス半径の違いにより起こる。2-アミノ安息香酸による糖の誘導体における分離について理論的考察を行った。50mMのリン酸緩衝液を泳動液として分離をしたとき、六炭糖であるManとGlc、また石炭糖であるRibとXylが顕著に分離した。このことから、分子量が同じであっても水酸基の向きが異なっていると、ストークス半径や電荷にわずかな違いが現れるということが示された。一方、糖とホウ酸の錯形成反応についても考察した。 また、卵殻膜をHPLCおよびキャピラリー電気泳動法を用いて糖の定量および糖鎖の構造を解明することを目的として検討を行った。卵殻膜の量は鶏卵1個あたり約120mgであった。フェノール硫酸法を行ったところ卵殻膜中の中性糖は重量の約1.0%であった。2-アミノ安息香酸標識して中性糖、アミノ糖の分析を行った結果、卵殻膜1gには、GlcN、GalN、Gal、Man、Glc、Fucがそれぞれ62.1、6.9、13.0、38.9、8.5、3.0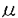 mol含まれていることが示された。また、HPLCとDMB標識法を用いて、シアル酸の分析を行った結果、Neu5Acの1種類だけが存在し、卵殻膜1gに対し3.2 mol含まれていることが示された。また、HPLCとDMB標識法を用いて、シアル酸の分析を行った結果、Neu5Acの1種類だけが存在し、卵殻膜1gに対し3.2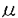 molであった。単糖組成分析の結果から、糖鎖の種類として、アスパラギン型、ムチン型がともに含まれていることが示唆された。 molであった。単糖組成分析の結果から、糖鎖の種類として、アスパラギン型、ムチン型がともに含まれていることが示唆された。 以上、本論文では、キャピラリー電気泳動を用いた糖の分析法について糖鎖構造解析の実用化へ向けての基礎的研究を示したもので、実用面および学術面に貢献することが少なくない。よって審査委員一同は本論文が博士(農学)の学位論文として価値あるものと認めた。 |