金属酵素は生物界に幅広く分布し、生命活動を営む上で重要な役割を担っている。例えば電子伝達系のように酸化還元反応を繰り返し、電子が移動していく系においては金属酵素は不可欠であり、これまでに数多くの金属酵素が見いだされている。脱窒光合成細菌Rhodobacter sphaeroides f.sp.denitrificans IL106は脱窒能を持つことが示された最初の光合成生物であり、脱窒の他に光合成、酸素呼吸、DMSO呼吸などを行うことによって生育することが可能である。本菌の嫌気呼吸における末端酸化還元酵素のうち、銅酵素である亜酸化窒素還元酵素、亜硝酸還元酵素およびモリブデン酵素であるDMSO還元酵素について研究を行った。
1.亜酸化窒素還元酵素(N2OR) 脱窒は窒素酸化物を最終電子受容体とする嫌気呼吸の一種で、NO3-をNO2-→NO→N2Oを経てN2へと還元する一連の生物的作用である。N2ORはこのうちの最終段階であるN2OからN2への2電子還元を触媒する酵素で、一般に補因子として複数の銅イオンを含み、特有の可視光吸収スペクトルを示し、酸素に対して不安定であることが報告されているが、反応のメカニズムなど詳しい性質は分かっておらず、高次構造も明らかになっていない。そこで脱窒光合成細菌R.sphaeroides f.sp.denitrificansからN2ORの精製を試み、その性質について検討を行った。
脱窒光合成条件下で培養した菌体から、硫安沈殿、Q Sepharose、Superdex、Resource Qの各クロマトグラフィーを用いてN2ORを精製した。精製は通常の好気的精製に加えて、N2飽和bufferを用いてN2雰囲気下で行う嫌気的精製も試み、得られた酵素の違いについても検討を行った。
精製N2ORはMALDI-TOFによる推定分子質量66180Da、ゲルろ過クロマトグラフィーによる推定分子質量105kDaのhomodimerであることがわかった。含有金属としては培地中の銅イオン濃度が比較的低い場合には亜鉛やニッケルが取り込まれることがあるものの、銅イオンが充分に存在する場合には銅のみが含まれ、その含有量はサブユニットあたり4原子であった。また培地中の銅イオンを増やすと、N2ORの比活性及び発現量が増加した。
精製N2ORは特有の可視光吸収スペクトルを示し、そのスペクトルは好気的に精製したものと嫌気的に精製したものとで、明らかに異なっていた(図1)。また精製酵素を過剰のsodium dithioniteを用いて還元した場合、スペクトルは大きく変化したが、失われずに残る吸収が存在することから、本酵素にはdithioniteでは還元されないCu2+が存在するものと思われた。
 図1 N2ORの可視光吸収スペクトル
図1 N2ORの可視光吸収スペクトル これまで一般にN2ORはdithioniteによって還元されると、活性を失うと報告されていたが、本菌のN2ORでは大過剰のdithioniteによる還元を行っても活性はほとんど低下せず、酵素活性測定時にメディエーターであるbenzyl viologenの還元にdithioniteを用いても活性測定を行うことが可能であった。
また本酵素はpH7付近においても活性を示すものの、benzyl viologen cation radical共存下pH9.0で嫌気的にインキュベートし、この条件下で活性測定を行うことによって大幅に活性が上昇した。嫌気的に精製した酵素は30分間のインキュベートで8倍程度活性が上昇したのに対し、好気的に精製した酵素では90分間インキュベートしても4倍程度しか活性は上昇しなかった。また本酵素の至適pHは8.5から9.0で、至適温度は60℃であった。
一般にN2ORは酸素に対して不安定であり、好気的条件下におかれると数日中に不可逆的に失活することが報告されているが、本菌のN2ORでは好気的に精製を行っても50%以上の活性を保持しており、精製酵素についても好気的条件下4℃、2ヶ月以上の保存でも80%の活性が保持された。可視光吸収スペクトルが変化することも考えると、本菌のN2ORは酸素の影響を受け、酵素の構造に何らかの変化が起こるものの、活性が取り戻せなくなるほどの大きな変化は起こらないことを示していると考えられる。
一方亜鉛イオンなどの一部の2価金属イオンも本酵素の阻害剤になりえたが、これらのイオンは精製酵素には影響を与えず、還元型の酵素はゆっくりと失活させるが(t1/2=75min by10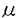 M Zn2+)、反応中の酵素は速やかに失活させる(t1/2=1.5min)ことが分かった。また前述の通り、酸素存在下での酵素活性の低下は僅かであるにも関わらず、反応中に反応溶液中に酸素が残存していると活性が明らかに低下していった。これらの結果より、本酵素は反応の進行中に阻害物質によって影響を受けやすい不安定な構造をとっているものと思われた。
M Zn2+)、反応中の酵素は速やかに失活させる(t1/2=1.5min)ことが分かった。また前述の通り、酸素存在下での酵素活性の低下は僅かであるにも関わらず、反応中に反応溶液中に酸素が残存していると活性が明らかに低下していった。これらの結果より、本酵素は反応の進行中に阻害物質によって影響を受けやすい不安定な構造をとっているものと思われた。
本酵素に対する生体内電子供与体については、本菌の電子伝達系における主要電子供与体タンパク質であるcytochrome c2が電子供与を行う可能性が報告されていたので、in vitroで反応するか検討を行った。その結果電子伝達が起こることは確認できたものの、今回検討した条件ではその速度は極めて遅く、直接の電子供与体であるとは考えにくい結果となった。
本酵素に含まれる銅の配位構造についての手がかりを得るために、電子スピン共鳴(ESR)を測定した。精製酵素のESRスペクトルはtype1及びtype2銅タンパク質のスペクトルとは異なる極めて小さい超微細分裂 を示した(図2)。一方還元型の酵素ではそれよりもやや大きい超微細分裂をもつスペクトルが得られ、dithioniteやascorbateによって還元されないCu2+が存在することが示された。どちらの場合にもESRによって、含まれる銅イオンのうちの20%以下しか検出されなかったため、本酵素中にはtype3銅またはCu+が存在しているものと思われた。さらに、精製酵素および還元型酵素はいずれも銅の配位構造及び価数が異なったいくつかの状態の混合物であることが示唆された。同時にパルスESRを用いたelectron spin echo envelope modulation(ESEEM)を測定し、その結果についても検討を行った。
を示した(図2)。一方還元型の酵素ではそれよりもやや大きい超微細分裂をもつスペクトルが得られ、dithioniteやascorbateによって還元されないCu2+が存在することが示された。どちらの場合にもESRによって、含まれる銅イオンのうちの20%以下しか検出されなかったため、本酵素中にはtype3銅またはCu+が存在しているものと思われた。さらに、精製酵素および還元型酵素はいずれも銅の配位構造及び価数が異なったいくつかの状態の混合物であることが示唆された。同時にパルスESRを用いたelectron spin echo envelope modulation(ESEEM)を測定し、その結果についても検討を行った。
 図2 N2ORのESRスペクトル
図2 N2ORのESRスペクトル 精製N2ORの結晶化をCrystal Screen Kit I及びIIを用いてhanging-drop vapor diffusion法で試みた。嫌気的に精製した酵素、好気的に精製した酵素、dithioniteで還元した酵素のそれぞれについて5℃〜25℃で、結晶化を試みたが、全く結晶は得られなかった。結晶しない理由のひとつとして、酵素が異なった状態の混合物であり、立体配座的に単一でないことが考えられた。
3.DMSO還元酵素(DMSOR) DMSO呼吸の末端酵素であるDMSO還元酵素はジメチルスルホキシド(DMSO)をジメチルスルフィドに2電子還元する酵素であり、最近これらの有機硫黄化合物が地球上の硫黄循環において重要な役割を果たしていることが明らかにされつつある。本酵素は酵素1分子あたり1原子のモリブデンをモリブドプテリングアニンジヌクレオチドの形で含んでいることが明らかとなっているが、モリブドプテリンコファクター含有酵素の構造に関する研究は極めて少なかったため、本酵素の構造解析を行うことを目的として、結晶化を試みた。
実験には高純度で大量の酵素が必要となるため、既報を改良した新たな方法で酵素の精製を行った。精製した酵素について、Crystal Screen Kit I及びIIなどを用いてhanging-drop vapor diffusion法で結晶化を試みた。様々な条件で結晶化を行ったところ、結晶化母液に1.85M硫酸アンモニウムin0.1M Tris-HCl pH8.25を用いて20℃で結晶化を行った場合に、比較的大きな単結晶を得ることができた。得られた結晶を用いて予備的なX線回折実験を行った結果、本結晶は斜方晶系でP21212の空間群に属し、格子定数はa=76.1Å,b=203.4Å,c=62.2Åであり、また2.7Å程度の分解能を有し、構造解析に用いることが可能であることが分かった。