癌化は、癌遺伝子の活性化を含む複数の遺伝子変異により成立する。ところが、癌遺伝子の中にはmycやE2F、cdc25A、アデノウイルスE1Aなどのように細胞周期をG1期からS期に進行させる役割を担うだけでなく、細胞に対してアポトーシス感受性を増大させるものが報告されている。したがって、これらの癌遺伝子が発現している細胞に対して選択的にアポトーシスを誘導する化合物は、ある種の癌に対して選択的な抗癌剤になりうると考えられる。 一方、癌細胞はアポトシースを抑制するシステムをも有している。アデノウイルス12型のE1B癌遺伝子は、アポトシース抑制因子であるBcl-2と同様の作用を示す19K蛋白質と、アポトシース誘導因子であるp53の転写活性化能を阻害する54K蛋白質をコードしており、これがE1A遺伝子とともに働くことにより、腫瘍細胞として安定した表現型を与える。また、ヒトパピローマウイルス16型のE7癌遺伝子産物はアデノウイルスE1Aと同様、癌抑制遺伝子産物であるRB蛋白質と結合してこれを不活性化するが、同じヒトパピローマウイルスのE6癌遺伝子産物はp53と結合し、その分解を促進する。 したがって、これらの癌遺伝子を細胞に導入することにより、アポトシース誘導と抑制機構のモデルを構築することができる。そこで、本研究では、癌細胞に対して選択的に作用する新しい抗癌剤の発見とアポトーシスの制御機構の解明をめざして、微生物代謝産物を対象として、癌遺伝子導入細胞に対して選択的なアポトーシス誘導物質の探索を試みた。 1.Apoptolidinに関する研究 アデノウイルスE1A癌遺伝子形質転換細胞に対して選択的アポトーシスを誘導する物質の探索を行った結果、土壌より分離した放線菌Nocardiopsis sp.3338-A1株の培養液から新規活性物質を単離し、apoptolidinと命名した。Apoptolidinの分子式は高分解能FABマススペクトルによりC58H96O21と決定した。 COSYおよびHMBC解析によりapoptolidinは3分子の糖を有するポリケタイドであることが判明し、apoptolidinをメタノリシスした後、加水分解してD-oleandrose、L-olivomycose、6-deoxy-4-O-methyl-L-glucoseを得た。また、スピン結合定数よりoleandroseは 結合、他の2つの糖は 結合、他の2つの糖は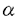 結合していることが判明した。HMBCスペクトルにおける遠距離スピン結合から、apoptolidinは20員環マクロライドと6員環ヘミケタール構造を有することが明らかとなり、同様にして3分子の糖とアグリコンの結合位置も判明した。二重結合の幾何異性はスピン結合定数とアリルメチル炭素の化学シフトによりすべてE配置であることが示され、これはNOESYスペクトルの解析より確認した。 結合していることが判明した。HMBCスペクトルにおける遠距離スピン結合から、apoptolidinは20員環マクロライドと6員環ヘミケタール構造を有することが明らかとなり、同様にして3分子の糖とアグリコンの結合位置も判明した。二重結合の幾何異性はスピン結合定数とアリルメチル炭素の化学シフトによりすべてE配置であることが示され、これはNOESYスペクトルの解析より確認した。 マクロライド環の立体構造決定への手掛かりは、既に絶対立体配置が判明している6-deoxy-4-O-methyl-L-glucoseとアグリコンのプロトン間のNOEに見出された。それに加えてスピン結合定数に基づく二面角情報によりグリコシド近傍の絶対立体配置を決定した。また、13位から16位の炭素鎖がループ型の立体配座、15位から20位の炭素鎖がジグザグ型の立体配座をとっていることもNOEより判明した。最も重要なNOEはマクロライド環上の3位と17位のプロトン間に観測された。この遠隔位NOEにより共役カルボニルの回転を含むマクロライド環の立体配座が明らかになり、スピン結合定数の情報と合わせてマクロライド環上のすべての立体配置が判明した。Apoptolidinの側鎖部分の立体構造解析は、側鎖末端部位のプロトンからマクロライド環のアリルメチルプロトンに対して観測されたNOEより示された折り畳み構造が鍵となった。さらに、いす型配座を含むテトラヒドロピラン環の立体構造を中心に、側鎖のプロトン間のNOEを詳細に解析することによりアグリコンの全立体配置を決定した。  図1.Apoptolidinの構造 図1.Apoptolidinの構造 ApoptolidinはE1A遺伝子を含む12型アデノウイルス癌遺伝子で形質転換した細胞に対しては低濃度で細胞死を誘導したが(IC5010〜17ng/ml)、正常細胞やその他の癌遺伝子で形質転換した3Y1細胞に対しては100 g/ml以下でほとんど効果が認められなかった。Apoptolidinで処理したE1A癌遺伝子導入細胞において、クロマチンの凝縮、核の断片化、DNAの断片化が観察されたことから、apoptolidinによる細胞死はアポトーシスによるものであることが確認された。また、apoptolidinによるアポトーシスはE1B癌遺伝子による抑制を受けないことが明らかとなった。 g/ml以下でほとんど効果が認められなかった。Apoptolidinで処理したE1A癌遺伝子導入細胞において、クロマチンの凝縮、核の断片化、DNAの断片化が観察されたことから、apoptolidinによる細胞死はアポトーシスによるものであることが確認された。また、apoptolidinによるアポトーシスはE1B癌遺伝子による抑制を受けないことが明らかとなった。 アデノウイルス癌遺伝子導入細胞をapoptolidinで処理するとカスパーゼ3様活性の上昇が認められたが、カスパーゼ阻害剤Z-Asp-DCBはapoptolidinによる細胞死を抑制できなかった。一方、活性酸素消去剤であるN-アセチルシステインやグルタチオンの存在下ではapoptolidinによる細胞死が抑制された。さらに、apoptolidin処理細胞において細胞内過酸化水素の上昇が確認され、本化合物のアポトシース誘導機構に過酸化水素の生成が関与していることが示唆された。 2.Oximidineに関する研究 ヒトパピローマウイルスのE6およびE7癌遺伝子を導入したラットグリア細胞に対して、選択的に細胞死を誘導する抗腫瘍物質の探索を行った結果、土壌より分離した細菌Pseudomonas sp.Q52002株の培養液から新規活性物質を見出し、oximidine IおよびIIと命名した。高分解能FAB-MSにより、それぞれの分子式はC23H24N2O7およびC23H24N2O6と決定した。 Oximidine IのCOSYスペクトル解析により判明した3つの部分構造(C-4〜C-6,C-8〜C-18,C-20〜C-22)の繋がりはHMBCスペクトル解析によって明らかになった。2位にカルボニル炭素が結合していることや、末端にO-メチルオキシム基が存在することは、HMBCスペクトルにおいて4-結合の遠距離スピン結合が観測されたことから判明し、oximidine Iはユニークな12員環マクロライドであることが明らかになった。オレフィンの幾何異性はスピン結合定数より8位はE配置、残りはすべてZ配置であることが示された。また、NOESYスペクトルからオキシムはE配置であると決定した。Oximidine Iのエポキシドはスピン結合定数とNOEよりシス配置であることが示され、13位と16位、11位と14位のプロトン間に観測されたNOEから12位、13位、14位、15位の相対立体配置が明らかになった。 さらに、その絶対立体配置を改良Mosher法により解析した。Oximidine IをRとSのMTPAクロライドと反応させ、生成物より14位のMTPAエステルを単離した。これらについて1H-NMRを測定した結果、14位の絶対立体配置をRと決定した。 Oximidine IIも同様の解析によりoximidine Iのエポキシドがオレフィンに置き換わった構造であると判明した。このオレフィンのプロトンスピン結合はシスとトランスの中間の値(12.5Hz)を示したが、NOE解析によりZ配置と決定した。 ウイルス癌遺伝子導入ラットグリア細胞と、各種癌遺伝子により形質転換したラット3Y1細胞について、oximidineの効果を検討した。Oximidine IおよびIIはヒトパピローマウイルスのE6およびE7遺伝子導入細胞に対して低濃度で(IC5038〜66ng/ml)アポトシースを誘導したが、正常グリア細胞に対する作用は弱いものであった(IC50>1 g/ml)。また、oximidine IおよびIIはさらに低濃度で(IC509.0〜27ng/ml)、rasやsrcにより形質転換した3Y1細胞の増殖を阻害した。一方、正常3Y1細胞やSV40形質転換細胞に対するIC50値は、それと比較して10倍以上の高い値を示した。 g/ml)。また、oximidine IおよびIIはさらに低濃度で(IC509.0〜27ng/ml)、rasやsrcにより形質転換した3Y1細胞の増殖を阻害した。一方、正常3Y1細胞やSV40形質転換細胞に対するIC50値は、それと比較して10倍以上の高い値を示した。 ras遺伝子形質転換3Y1細胞について、oximidine Iの効果をフローサイトメトリーを用いて検討した結果、oximidine IはアポトシースではなくG1期停止を誘導することが明らかとなった。この効果はsrc癌遺伝子導入細胞においても認められた。また、ras遺伝子導入3Y1細胞において、oximidine Iの処理によってサイクリン依存性キナーゼ阻害蛋白質であるp21WAF1の発現がmRNAおよび蛋白質レベルで上昇することが観察された。 p21WAF1の発現制御にはGTP結合蛋白質RhoAが関わっており、RhoAの機能を抑制するゲラニルゲラニルトランスフェラーゼ阻害剤で細胞を処理すると、p21WAF1の発現上昇とともにアクチンストレス繊維の消失が起こることが報告されている。そこで、3Y1細胞を用いて、アクチンストレス繊維をphalloidinで染色したところ、oximidin Iで処理した細胞においてアクチンストレス繊維の消失が認められた。したがって、oximidineの作用発現にRhoAによるシグナル伝達が関わっている可能性が示唆された。  図2.Oximidine IとIIの構造 図2.Oximidine IとIIの構造 |