藍藻からは、これまで抗菌、抗カビ、抗腫瘍などの生埋活性を有する数多くの新規化合物が得られ、新規有用物質の探索源として有望視されている。また、藍藻類の酵素阻害物質に関する研究は、Cannellらの阻害物質のスクリーニングに端を発するが、その活性の本体はほとんど明らかにされていない。生命現象には大なり小なり酵素反応が関与しており、これらの酵素反応の機構を解明することは生命現象の解明にもつながる重要な研究テーマである。酵素阻害物質は酵素反応の機構を解明するために必要不可欠である他、医薬および薬理試薬としての利用も考えられる。 申請者は、このような背景に基づき、酵素阻害活性試験で活性の認められた藍藻Nostoc minutum(NIES-26)およびN.linckia(NIES-25,28)より16種の酵素阻害物質を単離・構造決定した。本論文は、Nostoc類より酵素阻害物質を単離・構造決定するとともに、その阻害様式について考察を加えたものであり、4章よりなる。 第1章では、国立環境研究所より分譲を受けたN.minutum(NIES-26)およびN.linckia(NIES-25,28)から得られたnostopeptin類の単離・構造決定および構造活性相関について述べている。すなわち、これら藍藻類を10L瓶を用いてCB培地中25℃、明暗サイクル12L:12D、250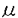 ・E-2・s-1の条件下で通気培養した。得られた凍結乾燥藻体を80%メタノールで抽出、溶媒分画、カラムクロマトグラフィー、ODSのHPLCにより精製し、N.minutum(NIES-26)よりnostopeptin B(1)、B’(2)およびA’(3)、N.linckia(NIES-25)よりnostopeptin C(4)、D(5)、E(6)、F(7)、G(8)およびH(9)、N.linckia(NIES-28)よりnostopeptin I(10)と命名した新規ペプチドを得た。 ・E-2・s-1の条件下で通気培養した。得られた凍結乾燥藻体を80%メタノールで抽出、溶媒分画、カラムクロマトグラフィー、ODSのHPLCにより精製し、N.minutum(NIES-26)よりnostopeptin B(1)、B’(2)およびA’(3)、N.linckia(NIES-25)よりnostopeptin C(4)、D(5)、E(6)、F(7)、G(8)およびH(9)、N.linckia(NIES-28)よりnostopeptin I(10)と命名した新規ペプチドを得た。 これらペプチドの平面構造は、FABMSおよび各種NMRスペクトルの解析により決定した。通常アミノ酸の立体化学は、酸加水分解物のキラルGC分析により、すべてL型、N-MeTyrまたN,O-diMeTyrはMarfey法により分析し、同じくL型であると決定した。また、3-Amino-6-hydroxy-2-piperidone(Ahp)、3-amino-6-methoxy-2-piperidone(Amp)、5-hydroxy-proline(Hp)、5-methoxy-proline(Mp)、3-hydroxy-4-methyl-proline(Hmp)の立体化学については、化学的手法とNMRスペクトルの解析を組み合わせることにより決定している。 Nostopeptin類のプロテアーゼに対する阻害活性は、Ahpを有するタイプの類縁体1および4〜7は類似した活性でキモトリプシンおよびエラスターゼを強く阻害した。しかし、Hpを有するタイプの類縁体8〜10はIC50=100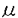 g/mLで阻害活性を示さなかった。重DMSO中、温度グランジエントによるアミドプロトンの化学シフトの変化を測定することにより、阻害活性を有する1および4〜7のAhpのアミドプロトンが分子内水素結合に関与していると推測し、活性の発現にはこの水素結合が必要不可欠であると結論している。 g/mLで阻害活性を示さなかった。重DMSO中、温度グランジエントによるアミドプロトンの化学シフトの変化を測定することにより、阻害活性を有する1および4〜7のAhpのアミドプロトンが分子内水素結合に関与していると推測し、活性の発現にはこの水素結合が必要不可欠であると結論している。 第2章では、N.minutum(NIES-26)の凍結乾燥藻体よりmicroviridin GおよびHと命名した新規環状ペプチドを得、その構造を立体化学を含めて決定した。これらのペプチドは、エラスターゼおよびキモトリプシンに対し非常に強い阻害活性を示した。 第3章では、N.minutum(NIES-26)の凍結乾燥藻体の80%メタノール抽出物よりminutumamide AおよびBと命名した新規環状ペプチドを得た。さらに、N.linckia(NIES-25)より類似ペプチドminutumamide CおよびDを単離・構造決定した。これらの化合物はいずれも新規 -アミノ酸4-amino-2-methyl-3-oxo-5-phenylvaleric acid(Amopa)を持つ環状ペプチドであった。Minutumamide AおよびCはチロシナーゼに対し、IC50=30 -アミノ酸4-amino-2-methyl-3-oxo-5-phenylvaleric acid(Amopa)を持つ環状ペプチドであった。Minutumamide AおよびCはチロシナーゼに対し、IC50=30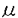 g/mLで阻害活性を示したが、minutumamide BおよびCはIC50=100 g/mLで阻害活性を示したが、minutumamide BおよびCはIC50=100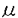 g/mLで活性を示さなかった。これはAmopaの g/mLで活性を示さなかった。これはAmopaの 位の立体の違いによるものと推測している。 位の立体の違いによるものと推測している。 第4章では、得られた結果について総合的な討論を行っている。 以上、本論文は、藍藻Nostoc minutum(NIES-26)およびN.linckia(NIES-25,28)より、16種の酵素阻害物質を単離・構造決定するとともにその構造活性相関について検討を加え、藍藻Nostoc類が酵素阻害物質の探索源として有望であることを明らかにしたものであり、学術上、応用上寄与するところが少なくない。よって、審査委員一同は、本論文が博士(農学)の学位論文として価値あるものと認めた。 |