| 背景: 多細胞生物は単細胞生物とは異なり、機能の異なる様々な細胞の統合により形成され個々の細胞の機能及び増殖は厳密に制御されている。多細胞生物を維持する代表的な制御機構には内分泌系、血液循環系、神経系そして免疫系などがある。細胞間の情報を伝達する様式は二通り存在する。一つは、膜結合型で細胞同士がリガンドとレセプターを介して直接物理的に接触することによる。もう一つは、細胞同士が離れている場合で可溶性の蛋白質とレセプターを介する細胞同士の接触を必要としない伝達法である。後者の可溶性情報伝達物質はサイトカインと呼ばれる。これら情報を介して細胞の増殖と分化は厳密に制御されている。 免疫系は生体を病原体の感染から守るための防御機構であり、B細胞、T細胞、マクロファージは中心的な役割を演じている。マクロファージ・スカベンジャーレセプター・システインリッチドメイン・スーパーファミリー(SRCR-SF)は最近発見された分子ファミリーであり、多くの蛋白質分子が種を越えてこれに属している。この分子群はアミノ酸、システインに富んだSRCRドメインと名付けられるユニークなドメインの存在によって特徴付けられる。このSRCRドメインは約100アミノ酸残基から成り、1ドメイン当りシステインを6から8残基含んでいる。システイン間の距離及びアミノ酸残基の配列は蛋白分子間でよく保存されている。SRCR分子群の高い相同性にもかかわらず、現在まで共通のリガンドは同定されていないことから個々の分子は異なる機能を有していると考えられている。現在までのところSRCRドメインの生理学的機能に関して共通した一致は得られていない。しかしながら、哺乳類SRCR-SF分子の多くは細胞表面蛋白としてあるいは分泌蛋白として宿主防御に関係している免疫担当細胞において発現されている。また、そのリガンドもまた同じ免疫担当細胞に発現しているため主要な役割は免疫反応の調節であり、細胞間の情報伝達に関わっていることが示唆されている。 本研究で新しくクローニングされた遺伝子はその遺伝子構造から分泌蛋白質であること、及びSRCR分子ファミリーに属することが判明し、免疫系で機能していることが示唆された。本研究では新しいSRCR-SF分子の遺伝子の単離、遺伝子構造の解析、組織発現の検討及び機能の同定を行い、この分子がサイトカインとして免疫系の制御に関わっていることを証明することを目的とした。また、本研究の後に新たな活性を同定したためこの分子をAIM(an apoptosis inhibitory factor expressed by macrophages)と命名した。以降、本研究では本サイトカイン名をAIMとする。 第一章: 新しいマウスSRCR-SF分子であるAIMのcDNAは、マウスMSRとの相同性を利用してマウスマクロファージcDNAライブラリーより単離された。AIMの蛋白翻訳領域はDNA塩基数1056-bpから成り352アミノ酸をコードしていた。システイン含量は26残基であった。蛋白のN末端には蛋白の細胞表面への細胞内輸送に必要な疎水性アミノ酸から成るシグナル配列を有していたが他には疎水性に富んだ領域を認めなかったことより分泌蛋白であると考えられた。アミノ酸配列よりAIMが3つのSRCRドメインから成り、3つのドメインから成るSRCR-SFメンバーであるCD5及びCD6に構造的にも類似し相同性も高いことが判明した。マウス各組織におけるAIM遺伝子の発現をノーザンブロット解析により検討した結果、脾臓と肝臓でわずかな発現が認められるのみであった。しかしながら、T細胞やB細胞を欠損しているRAG-2ノックアウトマウス腹空内接着性細胞(大部分がマクロファージであると考えられる)では顕著な発現が認められたことからAIMの発現は主にマクロファージであることが判明した。組み換えAIM蛋白がAIM過剰発現Chinese hamster ovary(CHO)細胞、AIMを組み込んだバキュロウイルス感染Trichoplusia ni egg細胞より作成された。また、大腸菌より得られた組み換えAIM蛋白はマウス免疫に利用しマウスAIMに対するモノクローナル抗体を2株得た。組み換えAIM蛋白の存在は、得られたモノクローナル抗体(5H7)によるウエスタンブロット解析により確認され、還元条件下SDS-PAGEにおいて約54kDaを示した。アミノ酸配列より予想されたマウスAIM蛋白は36kDaであったことより糖鎖叉はその他の修飾が予想された。まとめると、AIMはマクロファージより分泌される免疫系で機能していると推測される54kDaの分泌蛋白質である。 AIMの遺伝子構造、蛋白の構造そしてAIMの生体における重要性についてより詳しい情報を得るために、マウスAIM cDNAをプローブとして用い、ヒト脾臓cDNAライブラリーよりヒトAIM cDNAの単離を試みた。ヒトAIMの蛋白翻訳領域はDNA塩基数1041-bpから成り347アミノ酸をコードしていた。システイン残基は27であった。マウスAIMとの蛋白翻訳領域のアミノ酸配列の相同性は71%であり、塩基配列の相同性は76%であった。エキソン/イントロン構造を含むゲノム構造をAIMについてマウス及びヒトについて解析をPCR法およびsequencing法により行った結果、マウスAIM遺伝子は少なくとも5エキソンから成りイントロンの長さは3kb以上、1.6kb、0.7kb、1.8kbであること、ヒトAIMも同様に少なくとも5エキソンから成りイントロンの長さは3.5kb以上、1.2kb、1.1kb、1.3kbであることが判明し、ゲノム構造が種間でよく保存されていた。マウスAIMの発現はマクロファージで強く認められるが、一度プラスチックであるプレート上で培養するとその発現は16時間後に消失することからAIM mRNAがサイトカインなどのmRNA同様非常に不安定であることが示唆された。これは、マウスおよびヒトAIM cDNAの3’非翻訳領域でのAT-rich配列の存在により支持された。マウスAIM cDNAとの相同性を利用して得られたヒトcDNAがヒト対応物(ホモログ)であることをより確かにするために染色体位置が決定された。マウス、ヒトAIM遺伝子はそれぞれ染色体3番バンドF、染色体1-番q21-q23に位置していた。この領域はマウスとヒトで保存された領域であることが知られている。まとめると、AIMは種間で非常によく保存されておりその機能の重要性が示唆された。 第二章: AIMのアミノ酸配列から予想される構造はリンパ球上に発現している膜蛋白、CD5およびCD6の細胞外領域に類似している。これら分子の特異的結合蛋白は主に同じリンパ球上に発現されている。マクロファージより分泌されるAIMの受容体がリンパ球上に発現していることを仮定しリンパ球での機能解明を試みた。組み換え蛋白として哺乳類細胞であるマウスAIMを組み込んだCHO細胞の培養上清を用いた。マウスリンパ球を用いた種々のin vitro機能解析の結果、LPS刺激B細胞によるIgM及びIgG産生をTGF-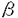 1と共に強く抑制することが判明した。IgMやIgG以外のすべての抗体のサブクラスの産生の増強は認められなかったためAIMとTGF- 1と共に強く抑制することが判明した。IgMやIgG以外のすべての抗体のサブクラスの産生の増強は認められなかったためAIMとTGF-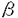 1によるこれら抗体産生の抑制はクラススイッチではなく増殖抑制の結果であることが考えられた。LPS刺激B細胞のTGF- 1によるこれら抗体産生の抑制はクラススイッチではなく増殖抑制の結果であることが考えられた。LPS刺激B細胞のTGF-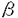 1による部分的な増殖抑制をAIMは共存下でほぼ完全に抑えることが確認された。AIM単独ではLPS刺激B細胞の抑制作用は認められなかった。LPS刺激B細胞をTGF- 1による部分的な増殖抑制をAIMは共存下でほぼ完全に抑えることが確認された。AIM単独ではLPS刺激B細胞の抑制作用は認められなかった。LPS刺激B細胞をTGF-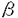 1で処理しTGF- 1で処理しTGF-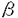 1を培養液中から除去後ではAIM単独でもその増殖を両サイトカインと同程度まで抑制した。この結果はLPS刺激B細胞の増殖抑制に対して必ずしも両サイトカインが同時に存在する必要がないことを示唆している。TGF- 1を培養液中から除去後ではAIM単独でもその増殖を両サイトカインと同程度まで抑制した。この結果はLPS刺激B細胞の増殖抑制に対して必ずしも両サイトカインが同時に存在する必要がないことを示唆している。TGF-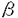 1によりLPS刺激B細胞のAIMに対する感受性が変化することが予想されたため、AIM蛋白のLPS刺激B細胞に対する結合性をFACScanにより解析した結果、TGF- 1によりLPS刺激B細胞のAIMに対する感受性が変化することが予想されたため、AIM蛋白のLPS刺激B細胞に対する結合性をFACScanにより解析した結果、TGF-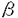 1により処理されたLPS刺激B細胞ではその結合性は著しく上昇しており、AIM受容体の発現増強あるいは親和性上昇を示唆した。また、LPS刺激B細胞はTGF- 1により処理されたLPS刺激B細胞ではその結合性は著しく上昇しており、AIM受容体の発現増強あるいは親和性上昇を示唆した。また、LPS刺激B細胞はTGF-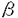 1によって増殖抑制を受けるがTGF- 1によって増殖抑制を受けるがTGF-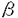 1を培養液中から除去すると再びLPSに反応して増殖を開始(可逆的)し、TGF- 1を培養液中から除去すると再びLPSに反応して増殖を開始(可逆的)し、TGF-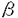 1およびAIM両方で処理されたLPS刺激B細胞は両サイトカイン除去後でもLPSに対し無反応であった(不可逆的)ため、両サイトカインによる増殖抑制は細胞内シグナル伝達を考える上で質的に異なることを示唆した。まとめると、もともと知られていたLPS刺激B細胞のTGF- 1およびAIM両方で処理されたLPS刺激B細胞は両サイトカイン除去後でもLPSに対し無反応であった(不可逆的)ため、両サイトカインによる増殖抑制は細胞内シグナル伝達を考える上で質的に異なることを示唆した。まとめると、もともと知られていたLPS刺激B細胞のTGF-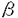 1による増殖抑制には2段階存在することが判明した:LPS刺激B細胞のTGF- 1による増殖抑制には2段階存在することが判明した:LPS刺激B細胞のTGF-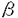 1による部分的な可逆的な増殖抑制、次いでB細胞上の仮想上のAIM受容体の発現増強あるいは親和性上昇、2段階目としてAIMによる完全な不可逆的な増殖抑制。 1による部分的な可逆的な増殖抑制、次いでB細胞上の仮想上のAIM受容体の発現増強あるいは親和性上昇、2段階目としてAIMによる完全な不可逆的な増殖抑制。 結論: TGF-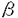 1はリンパ球増殖の恒常維持に関わっており、炎症部位、関節炎の炎症部位などで発現が認められている重要なサイトカインである。AIMは生体内において少なくともTGF- 1はリンパ球増殖の恒常維持に関わっており、炎症部位、関節炎の炎症部位などで発現が認められている重要なサイトカインである。AIMは生体内において少なくともTGF-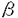 1による増殖抑制経路において、特に炎症部位でリンパ球の活性化などを調節していることが示唆された。もともと哺乳類SRCRファミリーの分子は免疫系において機能していると考えられていたが正確に機能が同定されたものはなかった。本研究は、新しいサイトカインを同定しただけでなく、SRCRファミリーに属する分子の免疫系における機能を明らかにしたところに意義がある。リンパ球の増殖機構ほどよく研究されていないがそれ以上に重要である増殖抑制機構は、同定されている因子がTGF- 1による増殖抑制経路において、特に炎症部位でリンパ球の活性化などを調節していることが示唆された。もともと哺乳類SRCRファミリーの分子は免疫系において機能していると考えられていたが正確に機能が同定されたものはなかった。本研究は、新しいサイトカインを同定しただけでなく、SRCRファミリーに属する分子の免疫系における機能を明らかにしたところに意義がある。リンパ球の増殖機構ほどよく研究されていないがそれ以上に重要である増殖抑制機構は、同定されている因子がTGF-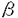 1だけであったこともありあまりよくわかっていない。本研究の新しい増殖抑制因子の発見はこの手助けになると考えられる。AIMは抗炎症作用を有する薬剤、あるいは、免疫抑制剤として臨床的に有用である可能性を持つ。 1だけであったこともありあまりよくわかっていない。本研究の新しい増殖抑制因子の発見はこの手助けになると考えられる。AIMは抗炎症作用を有する薬剤、あるいは、免疫抑制剤として臨床的に有用である可能性を持つ。 |