インターロイキン1(IL-1)はマクロファージ、リンパ球および線維芽細胞などから産生され、生体が受ける障害に対して急性期の反応を引き起こす多彩な作用を持った炎症性サイトカインである。IL-1はその多彩な生物学的作用から様々な疾患あるいは病態の形成に直接または間接的に関わっており、種々の炎症においてその慢性化とその結果としての組織破壊に中心的な役割を果たしていると考えられている。IL-1レセプターアンタゴニスト(IL-1ra)は主としてマクロファージから産生され、IL-1レセプターにIL-1(IL-1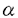 およびIL-1 およびIL-1 )と同等の親和性で結合することによりIL-1の生理活性を特異的に阻害し、炎症反応の抑制に重要な働きを担っている。炎症反応の持続や進展は、IL-1とIL-1raの時間的ならびに量的変動によって調節されていると考えられている。馬においては、関節炎、腱炎などの運動器の炎症性疾患が臨床上重要な問題となっており、サイトカインの測定やサイトカイン療法に関する研究が必要とされている。そこで、本研究では、馬の炎症性疾患における病態の解析および治療法の開発の基礎研究として馬IL-1ファミリーに関する分子生物学的研究を行った。 )と同等の親和性で結合することによりIL-1の生理活性を特異的に阻害し、炎症反応の抑制に重要な働きを担っている。炎症反応の持続や進展は、IL-1とIL-1raの時間的ならびに量的変動によって調節されていると考えられている。馬においては、関節炎、腱炎などの運動器の炎症性疾患が臨床上重要な問題となっており、サイトカインの測定やサイトカイン療法に関する研究が必要とされている。そこで、本研究では、馬の炎症性疾患における病態の解析および治療法の開発の基礎研究として馬IL-1ファミリーに関する分子生物学的研究を行った。 はじめに、第1章では、馬のIL-1(IL-1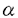 およびIL-1 およびIL-1 )の遺伝子クローニングを行った。lipopolysaccharide(LPS)で刺激した馬の末梢血単核球(PBMC)のmRNAから作成したcDNAを鋳型とし、ヒトおよびマウスの間でよく保存されている領域の塩基配列をもとに作成したプライマーを用いてpolymerase chain reaction(PCR)を行った。その結果、IL-1 )の遺伝子クローニングを行った。lipopolysaccharide(LPS)で刺激した馬の末梢血単核球(PBMC)のmRNAから作成したcDNAを鋳型とし、ヒトおよびマウスの間でよく保存されている領域の塩基配列をもとに作成したプライマーを用いてpolymerase chain reaction(PCR)を行った。その結果、IL-1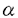 の全アミノ酸コード領域を含む932bpのDNAフラグメントおよびIL-1 の全アミノ酸コード領域を含む932bpのDNAフラグメントおよびIL-1 の全アミノ酸コード領域の約80%にあたる623bpのDNAフラグメントを増幅することができた。次に、LPS刺激した馬PBMC cDNAライブラリーをIL-1 の全アミノ酸コード領域の約80%にあたる623bpのDNAフラグメントを増幅することができた。次に、LPS刺激した馬PBMC cDNAライブラリーをIL-1 プローブでスクリーニングし、全アミノ酸コード領域を含むIL-1 プローブでスクリーニングし、全アミノ酸コード領域を含むIL-1 cDNAを単離した。このようにして得られたクローンの塩基配列を決定し、そのコードするアミノ酸配列を解析した。その結果、馬のIL-1 cDNAを単離した。このようにして得られたクローンの塩基配列を決定し、そのコードするアミノ酸配列を解析した。その結果、馬のIL-1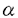 はヒトおよびマウスのIL-1 はヒトおよびマウスのIL-1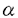 とそれぞれ71.6%および60.2%、また馬のIL-1 とそれぞれ71.6%および60.2%、また馬のIL-1 はヒトおよびマウスのIL-1 はヒトおよびマウスのIL-1 とそれぞれ66.7%および61.8%の相同性を示した。馬のIL-1 とそれぞれ66.7%および61.8%の相同性を示した。馬のIL-1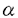 およびIL-1 およびIL-1 においても、とくにその構造および機能にとって重要と考えられるアミノ酸はきわめてよく保存されていた。さらに、馬のIL-1 においても、とくにその構造および機能にとって重要と考えられるアミノ酸はきわめてよく保存されていた。さらに、馬のIL-1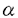 およびIL-1 およびIL-1 プローブを用い、ドットブロット法によって馬のPBMCでのIL-1の発現を検討したところ、IL-1の発現は無刺激のPBMCでは検出されなかったのに対し、LPSまたはphorbol myristate acetate(PMA)で刺激したPBMCでは著明に増強されていた。また馬においては、いずれの刺激に対しても主としてIL-1 プローブを用い、ドットブロット法によって馬のPBMCでのIL-1の発現を検討したところ、IL-1の発現は無刺激のPBMCでは検出されなかったのに対し、LPSまたはphorbol myristate acetate(PMA)で刺激したPBMCでは著明に増強されていた。また馬においては、いずれの刺激に対しても主としてIL-1 が発現していることが明らかとなった。今回得られた馬のIL-1 が発現していることが明らかとなった。今回得られた馬のIL-1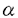 およびIL-1 およびIL-1 の遺伝子クローンは、今後、馬においてIL-1と種々の炎症性疾患との関わりを研究する上で、きわめて有用であると考えられた。 の遺伝子クローンは、今後、馬においてIL-1と種々の炎症性疾患との関わりを研究する上で、きわめて有用であると考えられた。 第2章では、近年、いくつかのサイトカインにおいて報告されているalternative splicingについて検討した。LPS刺激した馬のPBMCのmRNAから作成したcDNAを鋳型とし、第1章でクローニングした馬IL-1 cDNAの塩基配列をもとに作成したプライマーを用いてPCRを行ったところ、予想されるサイズ(約920bp)以外に約750bpのDNAフラグメントが増幅された。このDNAフラグメントをクローニングし、塩基配列を決定したところ、このクローン(ASE cDNAの塩基配列をもとに作成したプライマーを用いてPCRを行ったところ、予想されるサイズ(約920bp)以外に約750bpのDNAフラグメントが増幅された。このDNAフラグメントをクローニングし、塩基配列を決定したところ、このクローン(ASE )は、その中央部より5’側および3’側の塩基配列は通常のIL-1 )は、その中央部より5’側および3’側の塩基配列は通常のIL-1 (pE (pE 5)と同一であったが、中央部にframe shiftを引き起こさない162bpの欠損が認められた。この欠損領域はヒトおよびマウスIL-1 5)と同一であったが、中央部にframe shiftを引き起こさない162bpの欠損が認められた。この欠損領域はヒトおよびマウスIL-1 遺伝子のexon5に相当することが明らかとなった。また、馬のIL-1 遺伝子のexon5に相当することが明らかとなった。また、馬のIL-1 遺伝子のゲノミックDNAクローニングを行ったところ、この領域は馬においても1つのexonに相当することが確認された。次に、concanavalin A(Con A),phytohemagglutinin(PHA)およびPMAで刺激した馬のPBMCについて、欠損領域をはさむプライマーペアを用いたRT-PCR法を用い、alternatively spliced transcriptの発現を検討した。その結果、いずれの刺激においてもnormal type transcriptの他にalternatively spliced transcriptの発現が検出され、そのcDNAフラグメントの塩基配列はASE 遺伝子のゲノミックDNAクローニングを行ったところ、この領域は馬においても1つのexonに相当することが確認された。次に、concanavalin A(Con A),phytohemagglutinin(PHA)およびPMAで刺激した馬のPBMCについて、欠損領域をはさむプライマーペアを用いたRT-PCR法を用い、alternatively spliced transcriptの発現を検討した。その結果、いずれの刺激においてもnormal type transcriptの他にalternatively spliced transcriptの発現が検出され、そのcDNAフラグメントの塩基配列はASE と同一であることがわかった。これらのことから、IL-1 と同一であることがわかった。これらのことから、IL-1 においてもalternatively spliced transcriptが存在することが示された。ヒトおよびマウスのIL-1はその前駆体に付加された脂肪酸を介して膜に結合し、その後IL-1 においてもalternatively spliced transcriptが存在することが示された。ヒトおよびマウスのIL-1はその前駆体に付加された脂肪酸を介して膜に結合し、その後IL-1 converting enzyme(ICE)によってexon5由来領域で切断され、細胞外に放出される。今回得られたIL-1 converting enzyme(ICE)によってexon5由来領域で切断され、細胞外に放出される。今回得られたIL-1 のalternatively spliced transcript(ASE のalternatively spliced transcript(ASE )は脂肪酸付加部位は保持していたがICEよる切断部位を欠損していることが示されたため、膜結合型もしくは細胞内型IL-1 )は脂肪酸付加部位は保持していたがICEよる切断部位を欠損していることが示されたため、膜結合型もしくは細胞内型IL-1 をコードしている可能性が示唆された。 をコードしている可能性が示唆された。 第3章では、馬のIL-1raの遺伝子クローニングおよび馬リコンビナントIL-1raの発現を行った。第1章と同様の方法で、LPS刺激した馬PBMC cDNAライブラリーを馬IL-1ra cDNAプローブでスクリーニングしたところ、530bpのコード領域および1043bpの3’非翻訳領域を含む馬L-1ra cDNAクローンを単離することができた。しかし、得られたクローンは5’側アミノ酸コード領域を一部欠如しているものであったため、馬PBMC cDNAプラスミドライブラリーからプラスミドの配列を利用したRACE(rapid amplification of cDNA ends)法によってその欠如していた5’側アミノ酸コード領域を含むクローンを得た。これら2クローンを組み合わせることにより全アミノ酸コード領域を含む馬IL-1raの塩基配列を決定することができた。その結果、馬IL-1raは、ヒト、マウスおよびウサギのIL-1raとアミノ酸レベルでそれぞれ75.7%,75.3%および76.3%の相同性を示した。また、ヒト、マウス、ウサギにおいて同一部位に存在するN-glycosylation siteは馬においても同一部位に存在しており、種間において保存されている5つのシステイン残基は馬においても保存されていた。次に、馬IL-1ra cDNAをgluthathione S-transferase(GST)遺伝子をもつpGEX発現ベクターに組み込み、大腸菌を用いた蛋白発現系によりGST-馬IL-1ra融合蛋白を得た。得られた馬リコンビナントIL-1raの生物活性をIL-1により増殖が抑制されるヒトメラノーマ由来A375S2細胞を用いたバイオアッセイにより検討しところ、得られた馬リコンビナントIL-1raは、IL-1による細胞増殖抑制を濃度依存的に阻害したことから、生理活性を有することが確認された。 本研究で得られた馬のIL-1(IL-1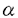 およびIL-1 およびIL-1 )およびIL-1raの遺伝子クローンならびにこれらのクローンより発現される蛋白は、今後馬の炎症性疾患の病態とIL-1ファミリーの関与を検討する上で非常に有用であるとともに、馬の炎症性疾患に対する新しいサイトカイン療法の開発に利用できるものと考えられた。また、馬におけるIL-1raによるサイトカイン療法の開発は、ヒトや他の動物における新しいサイトカイン療法の開発にも有用な知見をもたらすものと考えられた。 )およびIL-1raの遺伝子クローンならびにこれらのクローンより発現される蛋白は、今後馬の炎症性疾患の病態とIL-1ファミリーの関与を検討する上で非常に有用であるとともに、馬の炎症性疾患に対する新しいサイトカイン療法の開発に利用できるものと考えられた。また、馬におけるIL-1raによるサイトカイン療法の開発は、ヒトや他の動物における新しいサイトカイン療法の開発にも有用な知見をもたらすものと考えられた。 |