本研究は感染や炎症惹起に深く関わっていると考えられるロイコトリエンB4(LTB4)の実質臓器での不活性化経路の初発酵素であるLTB412-水酸基脱水素酵素(LTB412HDを、小動物でアレルギー性疾患や炎症のモデル動物として頻用されるモルモットより単離を試み、下記の結果を得ている。 1.既知のブタ、ヒトのLTB412HDの塩基配列を元にしてモルモットの本酵素を肝臓のcDNAライブラリーからクローニングし、塩基配列と推測されるアミノ酸配列を決定した。このcDNAは329個のアミノ酸をコードする987bpのタンパク翻訳領域を含み、コードされるタンパク質はブタ酵素とアミノ酸同一性が78%であった。NAD+/NADP+結合に重要と思われるアミノ酸配列はモルモット、ブタ、ヒト、ウサギでよく保存されていた。 2.モルモットLTB412HDをコードしているcDNAをGST融合タンパク質として大腸菌に発現させ精製し、酵素学的特性を検討した。LTB4を基質に用いた場合の反応生成物は12-keto-LTB4であった。Km値は91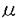 M,Vmaxは1.7nmol/min/mg proteinであった。ブタの酵素(Km=8 M,Vmaxは1.7nmol/min/mg proteinであった。ブタの酵素(Km=8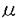 M,Vmax=8nmol/min/mg potein)に比べKm値は高く,Vmaxは低かった。 M,Vmax=8nmol/min/mg potein)に比べKm値は高く,Vmaxは低かった。 最近、本酵素がプロスタグランジン(PG)代謝物の15-keto-PGを基質にして13,14-dihydro-15-keto-PGを生成する15-keto-PG 13-還元酵素であることが報告されたことより、本活性の酵素学的検討も行った。15-keto-PGE2を基質に用いた場合の反応生成物が13,14-dihydro-15-keto-PGE2であることを二次元薄層クロマトグラフィー(二次元TLC)より確認した。Km値は35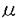 M、Vmaxは330nmol/min/mg proteinであった。LTB4より15-keto-PGE2を良い基質とすることが明らかとなった。 M、Vmaxは330nmol/min/mg proteinであった。LTB4より15-keto-PGE2を良い基質とすることが明らかとなった。 3.ノザンブロットとウエスタンブロット分析より、本酵素は小腸、肝臓、腎臓、大腸、胃、脾臓に発現が見られた。 4.免疫組織学的に本酵素の臓器内分布を検討したところ、腎臓で腎杯と集合管、肺で気管支軟骨細胞と肺胞と気管支平滑筋細胞、胃で粘膜細胞と筋層、小腸で絨毛と筋層に検出された。肝臓と脾臓では全体に発現がみられた。本酵素はこれらの臓器でPGとLTB4の代謝に関与しているものと考えられた。 以上、本論文はモルモットよりLTB412-HDのcDNAクローニングを行い、リコンビナントタンパク質を用いた酵素学的検討を行った。また、抗体を作成し免疫組織化学的な検討を行なった。さらに本酵素はLTB4を基質とする場合は水酸基の酸化反応、15-keto-PGを基質にする場合は二重結合の還元反応を行うという二つの酵素活性を合わせ持つdual functional enzymeであることが明らかになった。 酵素学的検討や組織(内)分布が本酵素の生理的意義や病的状態の解明に貢献すると考えられ、学位の授与に値するものと考えられる。 |