顆粒球マクロファージコロニー刺激因子(GM-CSF)は、多くの重要な生理活性を有するサイトカインである。GM-CSFの作用は、細胞膜上に発現する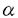 鎖と 鎖と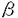 鎖で構成される特異的なレセプターを介して標的細胞内に伝達される。本研究は、GM-CSFレセプターからのシグナル伝達機構を解明するために、試験管内でGM-CSF依存的なシグナル伝達の活性化を誘導するin vitro系の開発を行ったものである。無細胞抽出液中で、GM-CSF依存的にシグナル伝達経路を活性化することができれば、抽出液をカラムクロマトグラフィー等により分画し、再構成することによって、そのシグナル伝達経路の活性化因子あるいは抑制因子を分離・精製し、同定するというアプローチが可能になる。さらに、抽出液に合成ペプチドやシグナル因子の抗体、精製蛋白質を添加することにより、シグナル因子の機能を解析することができるという利点がある。このような、従来のシグナル伝達の研究方法では困難な解析を可能にするin vitro系の開発を試み、下記の結果を得ている。 鎖で構成される特異的なレセプターを介して標的細胞内に伝達される。本研究は、GM-CSFレセプターからのシグナル伝達機構を解明するために、試験管内でGM-CSF依存的なシグナル伝達の活性化を誘導するin vitro系の開発を行ったものである。無細胞抽出液中で、GM-CSF依存的にシグナル伝達経路を活性化することができれば、抽出液をカラムクロマトグラフィー等により分画し、再構成することによって、そのシグナル伝達経路の活性化因子あるいは抑制因子を分離・精製し、同定するというアプローチが可能になる。さらに、抽出液に合成ペプチドやシグナル因子の抗体、精製蛋白質を添加することにより、シグナル因子の機能を解析することができるという利点がある。このような、従来のシグナル伝達の研究方法では困難な解析を可能にするin vitro系の開発を試み、下記の結果を得ている。 1.ヒトGM-CSFレセプターを発現させたマウスIL-3依存性細胞株BA/F3から、未刺激の状態で細胞膜と細胞質画分を含む無細胞抽出液を調製し、これに試験管内でヒトGM-CSFを添加することによりシグナル伝達経路の活性化を誘導できるin vitro系の開発を行った。GM-CSFの刺激によりチロシンリン酸化を受け、活性化する転写因子STAT5のDNA結合能を指標に条件検討を行った結果、in vitroでGM-CSF依存的にSTAT5の活性化が誘導される条件を見いだすことに成功した。抗体を用いた阻害実験など種々の解析から、このin vitro系でのSTAT5の活性化は、in vivoでのそれをよく反映していることが確認された。 2.これまでの変異型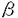 鎖を用いたin vivoでの解析から、GM-CSFによるSTAT5の活性化には 鎖を用いたin vivoでの解析から、GM-CSFによるSTAT5の活性化には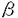 鎖細胞内領域のチロシン残基が重要であることが明らかになっており、このことは本研究で確立したin vitro系においても確認できた。そこで、 鎖細胞内領域のチロシン残基が重要であることが明らかになっており、このことは本研究で確立したin vitro系においても確認できた。そこで、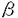 鎖細胞内領域に存在する8箇所のチロシン残基のSTAT5活性化における役割について、in vitro系を用いて解析を行った。8箇所のチロシン残基それぞれについて、チロシンリン酸化型と非リン酸化型の合成ペプチドを作製し、BA/F3細胞の抽出液に添加してin vitro系でのSTAT5の活性化に対する影響を検討した。その結果、GM-CSF刺激前にリン酸化型ペプチドを添加すると、STAT5のチロシンリン酸化およびDNA結合能が阻害された。これに対し、GM-CSF刺激後にリン酸化型ペプチドを添加した場合には、STAT5のチロシンリン酸化は阻害されなかった。さらに、これらのペプチドをビーズに結合させ、BA/F3細胞の細胞抽出液からのpull down assayを行うと、すべてのリン酸化型ペプチドにおいてSTAT5との結合がみられた。これらの結果から、STAT5の活性化において、 鎖細胞内領域に存在する8箇所のチロシン残基のSTAT5活性化における役割について、in vitro系を用いて解析を行った。8箇所のチロシン残基それぞれについて、チロシンリン酸化型と非リン酸化型の合成ペプチドを作製し、BA/F3細胞の抽出液に添加してin vitro系でのSTAT5の活性化に対する影響を検討した。その結果、GM-CSF刺激前にリン酸化型ペプチドを添加すると、STAT5のチロシンリン酸化およびDNA結合能が阻害された。これに対し、GM-CSF刺激後にリン酸化型ペプチドを添加した場合には、STAT5のチロシンリン酸化は阻害されなかった。さらに、これらのペプチドをビーズに結合させ、BA/F3細胞の細胞抽出液からのpull down assayを行うと、すべてのリン酸化型ペプチドにおいてSTAT5との結合がみられた。これらの結果から、STAT5の活性化において、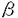 鎖の各々のチロシン残基がGM-CSFの刺激によりリン酸化を受けてSTAT5の結合部位として機能し、STAT5はレセプターのチロシンリン酸化部位に結合した後にチロシンリン酸化を受け活性化されることが示唆された。 鎖の各々のチロシン残基がGM-CSFの刺激によりリン酸化を受けてSTAT5の結合部位として機能し、STAT5はレセプターのチロシンリン酸化部位に結合した後にチロシンリン酸化を受け活性化されることが示唆された。 以上、本論文は、GM-CSF依存的なシグナル伝達経路の活性化を試験管内で誘導するin vitroを開発し、GM-CSFによるSTAT5活性化において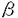 鎖のチロシン残基がSTAT5の結合部位として機能しうることを示した。本研究で開発されたin vitro系をさらに発展させることにより、これまでまだ明らかにされていない、GM-CSFによるc-myc遺伝子の発現誘導、DNA合成、細胞周期の進行、アポトーシス抑制等に至るシグナル伝達経路の解明につながると考えられる。従って、本研究は未解明の点が多いGM-CSFのシグナル伝達機構の解明に大きく貢献したと考えられ、学位の授与に価するものと考えられる。 鎖のチロシン残基がSTAT5の結合部位として機能しうることを示した。本研究で開発されたin vitro系をさらに発展させることにより、これまでまだ明らかにされていない、GM-CSFによるc-myc遺伝子の発現誘導、DNA合成、細胞周期の進行、アポトーシス抑制等に至るシグナル伝達経路の解明につながると考えられる。従って、本研究は未解明の点が多いGM-CSFのシグナル伝達機構の解明に大きく貢献したと考えられ、学位の授与に価するものと考えられる。 |