癌抑制遺伝子p53の変異はヒトの癌で50%以上もの頻度で見いだされている。p53蛋白質の本来の機能が遺伝子変異などによって阻害されることが癌化の大きな要因と考えられ、p53の機能を解明することは、ヒトの発癌機構を解明するうえで非常に重要である。 野生型p53蛋白質はカルボキシル末端に存在する核移行シグナル(NLS)配列の働きにより核に輸送される。NLS配列に突然変異が導入されたp53変異体は、活性化rasによる細胞のトランスフォーメーション活性を抑制する作用が完全に失われることが報告されている。また、正常なNLS配列を保持しているにもかかわらず野生型p53蛋白質が核移行能を消失している症例がいくつかの早期癌の細胞で認められ、p53蛋白質の癌抑制遺伝子としての機能には、核に局在することが必須であると考えられている。本来、野生型p53蛋白質は核内で転写因子として作用し、細胞増殖の制御に関与する様々な標的遺伝子の転写を活性化させることが知られている。この転写因子として機能しているp53蛋白質は、多量体形成領域(オリゴマー形成ドメイン)を介し、4量体を形成して特定のDNA配列に結合している。オリゴマー形成ドメインの変異体は、p53蛋白質の標的遺伝子である細胞周期の制御に関る遺伝子の発現を誘導することができないために、G1期停止作用およびアポトーシス誘導作用を失い、細胞増殖抑制作用を持たないことが報告されている。また、これまでにヒトの癌で見つけられたp53変異のほとんどはp53蛋白質の中央のDNA結合領域に集中しているが、これらの変異型p53蛋白質は、ヘテロ接合性の細胞において野生型p53蛋白質の細胞増殖抑制作用を阻害する、いわゆるドミナントネガティブ効果をもつことが知られている。その原因として、変異型p53蛋白質が野生型p53蛋白質とオリゴマー形成ドメインを介してヘテロオリゴマーを形成することにより、野生型p53蛋白質のDNA結合能を阻害するためであることが強く示唆されている。 このようにオリゴマー形成はp53蛋白質の転写因子としての働きに必須であることが示されている。しかし、核移行の過程でどのようにp53蛋白質のオリゴマー形成が起こるのかについては明らかにされていない。そこで我々はp53蛋白質の核輸送、とりわけ核輸送の経路におけるオリゴマー形成の機序に着目し、本論文中で、核移行の際にp53蛋白質がオリゴマーを形成していることが必要であるのか、あるいはモノマーとして存在しているのかを明らかにするために、蛋白質の輸送について解析の進んでいる、アフリカツメガエル(Xenopus laevis)の卵の系を用いて解析することを試みた。 本研究では、NLSをもつ変異体と持たない変異体の2種類のヒトp53変異体を作成し、まずそれらを用いた免疫沈降アッセイ系を確立し、ついでその後の一連の解析に利用した。NLSを持つp53変異体N1とNLS欠失型変異体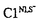 は、ともにオリゴマー形成ドメインを保持しているが、サイズの違いに加え、2種の異なるの抗p53モノクローナル抗体に対する認識部位の有無により、免疫的に識別が可能である。この性質を利用し、in vitro翻訳系で生成された産物を用いて免疫沈降アッセイを行い、これらのp53変異体がオリゴマーを形成するか否かについて検討した。その結果、in vitroにおいて は、ともにオリゴマー形成ドメインを保持しているが、サイズの違いに加え、2種の異なるの抗p53モノクローナル抗体に対する認識部位の有無により、免疫的に識別が可能である。この性質を利用し、in vitro翻訳系で生成された産物を用いて免疫沈降アッセイを行い、これらのp53変異体がオリゴマーを形成するか否かについて検討した。その結果、in vitroにおいて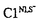 とN1がヘテロオリゴマーを形成することが観察され、p53蛋白質のオリゴマー形成をin vitroで簡便に検出できる免疫沈降アッセイ系を確立することができた。 とN1がヘテロオリゴマーを形成することが観察され、p53蛋白質のオリゴマー形成をin vitroで簡便に検出できる免疫沈降アッセイ系を確立することができた。 次に、これら2種類のヒトp53変異体のmRNAをin vitroで合成させ、2細胞期のXenopusの卵に注入してその発現を調べた。mRNA注入後すぐに蛋白質の合成が開始され、ヒトp53蛋白質はXenopusの卵において高効率で安定に発現していることが観察された。一方で、ヒトp53蛋白質はXenopusの発生に影響を与えなかったことから、我々の用いた系においては、ヒトp53の発現によって生じる細胞増殖抑制などの生物学的要因の影響を考慮することなく核輸送の現象について観察することができると考えられた。そこで、mRNAが注入されてから約7時間後、細胞内で核と細胞質が明確に区画化されるstage10に至った段階で、これらのp53変異体の細胞内局在をwhole-mount immunostaining法によって調べた。その結果、NLS欠失型p53変異体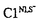 は細胞質に存在し、一方NLSを持つ変異体N1は核に局在していた。このことから、ヒトp53はXenopusの卵においてもNLS依存的な細胞内分布を示すことが明らかとなり、p53蛋白質の輸送の基本的な経路ではヒトとXenopusで類似の機構が働いていることが示された。 は細胞質に存在し、一方NLSを持つ変異体N1は核に局在していた。このことから、ヒトp53はXenopusの卵においてもNLS依存的な細胞内分布を示すことが明らかとなり、p53蛋白質の輸送の基本的な経路ではヒトとXenopusで類似の機構が働いていることが示された。 さらに、NLSを欠くp53蛋白質が細胞質においてもオリゴマーを形成する能力を保持しているか検討する目的で、抗体によって識別が可能な2種類のNLS欠失型p53変異体のmRNAをXenopusの卵に注入し、その発現産物を用いて上述のin vitro免疫沈降アッセイと同様の実験を行った。なお、これらの変異体が細胞質に局在することをwhole-mount immunostaining法によって確かめている。その結果、細胞質局在性p53蛋白質のオリゴマー複合体が検出され、in vivoでNLS変異体はオリゴマーを形成する能力を失っておらず、また、p53蛋白質は核内のみならず、細胞質においてもオリゴマーを形成しうることが示された。 そこで、Xenopusの卵においてオリゴマー形成が細胞質で起こるならば、本来細胞質局在性を示す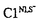 が、NLSを持っているN1の共存下では、N1に結合し、核内に共移入されることが考えられた。しかし、実際の生体内では、p53蛋白質は細胞質で合成された後、非常に速い速度で核に輸送されることが報告されていること等から、p53蛋白質はオリゴマー形成以前にモノマーとして核に移行する可能性が高いと考えられた。即ち、N1の共発現下においても、 が、NLSを持っているN1の共存下では、N1に結合し、核内に共移入されることが考えられた。しかし、実際の生体内では、p53蛋白質は細胞質で合成された後、非常に速い速度で核に輸送されることが報告されていること等から、p53蛋白質はオリゴマー形成以前にモノマーとして核に移行する可能性が高いと考えられた。即ち、N1の共発現下においても、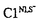 は細胞質にとどまることが推測された。この仮説に基づき、実際に は細胞質にとどまることが推測された。この仮説に基づき、実際に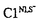 とN1のmRNAをXenopusの卵に共に注入して、 とN1のmRNAをXenopusの卵に共に注入して、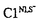 の細胞内局在の変化を調べた。その結果、予想されたとおり、N1を共発現させても の細胞内局在の変化を調べた。その結果、予想されたとおり、N1を共発現させても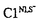 の細胞内局在性に変化は見られず、核への共移入は起こらなかった。またこの時、N1の核移行も阻害されず、 の細胞内局在性に変化は見られず、核への共移入は起こらなかった。またこの時、N1の核移行も阻害されず、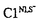 とN1は互いの細胞内局在性に影響を与えないことが示された。 とN1は互いの細胞内局在性に影響を与えないことが示された。 これらの観察結果から、p53蛋白質の核輸送にオリゴマーの形成はあらかじめ必要とされず、モノマーとして核内に運ばれることが示され、核でDNAに結合している4量体p53蛋白質は、核内で形成されたものであることが明かとなった。得られた結果は、オリゴマー形成の分子機構を明らかにしたばかりでなく、NLS欠失型の変異体は、ヘテロ接合型の細胞においても野生型と共に核に移行することができないために、核内で野生型の機能を阻害できないことから、ドミナントネガティブ効果を持たないことを示唆している。そこで、NLS欠失型変異体のドミナントネガティブ効果についてヒトSaos-2細胞を用いたCATアッセイにより検討を試みた。野性型p53により転写活性化されることが知られているクレアチンキナーゼのプロモーター配列を挿入したCATレポータープラスミドをNLS欠失型変異体および野性型p53発現プラスミドとともに細胞に導入したところ、NLS欠失型の変異体は野性型による転写活性化作用を阻害せず、NLS欠失型変異体はドミナントネガティブ効果を持たないことが示され、Xenopusを用いた実験から導かれた作業仮説が支持された。 癌の発症および進展に関与するp53遺伝子の機能の喪失について、Rb遺伝子等の他の癌抑制遺伝子と同様に、いわゆる’two-hit’説が広く受け入れられていたが、相同染色体上の少なくとも一方では野性型が保持されている例が多くの癌で見つけられ、双方のp53遺伝子の不活化は必ずしも必要でないことが示唆されるようになってきた。p53遺伝子変異による細胞癌化の発生機序はその変異体の特性や遺伝的背景等により多様であると考えられる。NLS欠失型変異では、本研究によりヘテロ接合性の細胞においてそれ自身は核に移行せず、またドミナントネガティブ効果を持たないことが示されたことから、片アレルのp53遺伝子をノックアウトしたマウス(p53+/-)に見られる様な、量依存的な効果にもとづく癌化の過程をたどることが推測される。また、早期癌の細胞でみつけられた野生型p53の核移行能消失現象の解析にこのようなNLS欠失型の変異体を利用することも可能であると考えられ、その発癌機構の解明に手掛かりが与えられることを期待している。 |