細胞内のセカンドメッセンジャーであるcAMPは細胞外からのシグナルを核内に伝え、細胞の増殖の制御に重要な役割を果たしている。増殖因子の作用による細胞内のcAMP濃度の上昇によって一群の遺伝子の発現が誘導される。これらの遺伝子の転写制御領域には共通のDNA配列TGACGTCAが存在し、CREと呼ばれている。1988〜1989年にかけてCREに結合する因子のクローニングが行われATFとCREBという2つのタイプの転写因子の存在が明らかにされた。ATF/CREB family memberはb-ZIPと呼ばれる塩基性のアミノ酸のクラスターとそれに続くロイシンジッパー領域から構成されるDNA結合領域を持っている。ATF/CREB family memberはこのロイシンジッパーを介してホモダイマー、あるいはメンバー間でヘテロダイマーを形成してCREに結合することができる。ATF familyは構造上さらにサブグループに分けられATF-2,ATFa,CRE-BPaで1つのATF-2subgroupを構成している。このサブグループの特徴はN端に非常によく保存されたmetal finger構造を含む転写活性化領域を持つことである。この3つのメンバーの中ではATF-2が最もよく研究されている。 ATF-2の転写活性化の機構としては現在までに2つの異なるメカニズムが報告されている。1つ目はJNKやp38などのSAPKによるThr69.71,Ser90のリン酸化が挙げられる。UV照射、高浸透圧ショック、熱ショックなどの細胞外のストレスによってJNKやp38などのSAPKがリン酸化を受けて活性化する。活性化したSAPKによってATF-2のN端Thr69.71,Ser90がリン酸化を受けるとATF-2の転写活性化能が上昇する。一方、CREBはSAPKではなくPKAによってSer133がリン酸化を受けることが知られている。このことはATF-2とCREBはそれぞれ異なるシグナル伝達系に属していることを示している。2つ目のATF-2の活性化のメカニズムにはアデノウイルスEIA13Sとの結合によるものが挙げられる。EIA13Sはアデノウイルスの初期遺伝子産物の1つであり細胞の癌化、不死化、DNAの合成の誘導、細胞増殖などの多面的な機能を有している。EIA13S自身はDNA結合活性を持たないが、宿主細胞由来の転写因子と結合することによって標的遺伝子の制御領域内の特異的なDNA elementに結合し転写を活性化する。ATF-2はそのb-ZIP領域がEIA13SのCR3領域と結合することによって、EIA13Sによる転写活性化をうける転写因子の1つである。 (1)ATF-2とCBPの相互作用 最近、ATF-2のb-ZIP領域がATF-2自身のN端領域と分子内で結合していることが報告された。この分子内結合によりN端に存在するATF-2の転写活性化領域はマスキングされているためにATF-2は不活性化された状態となっている。しかし、どのようにしてこの分子内結合がはずれてATF-2が活性化状態になるのかについては不明であった。本研究によりco-activatorとして知られているCBPがATF-2のb-ZIP領域に結合することによってATF-2の分子内結合をはずしてATF-2を活性化型にしていることが明らかになった。CBPはもともとPKAによってリン酸化されたCREBに特異的に結合しCREBの転写活性化能を上昇させる分子として同定された。さらにCBPはTFIIB,RNA pol IIなどの基本転写因子と相互作用することによってCREBと基本転写因子とをつなぐbridgeの役目を担っていることが示唆された。その後の解析によりCBPはCREBだけでなく様々な転写因子と結合し、細胞周期、細胞増殖、分化、発生などの多くのシグナル伝達系に深く関わっていることが示された。さらに最近CBPがhistone acetyltransferase活性を持ちクロマチンのremodelingに関わっていることがいくつかのグループより報告されている。 私は、CBPがb-ZIP family memberであるCREB,c-Jun,JunB,ATF-4などのco-activatorとしても機能していることから、同じb-ZIP familyに属するATF-2とCBPとの関係について実験を行ったところ、CBPはATF-2とも結合しATF-2のco-activatorとしても機能していることが明らかになった。さらにCBPはATF-2のb-ZIP領域に結合することによってATF-2の分子内結合を解除していることが解明された。また、EIA13SについてもATF-2の分子内結合の解除に関してCBPと同様の効果があることが分かった。本研究によりATF-2がどのようなメカニズムで不活性型から活性型になるのかが明らかとなった。 (2)TGF-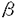 シグナル伝達系におけるATF-2の機能 シグナル伝達系におけるATF-2の機能 TGF-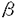 はactivin,BMPを含むTGF- はactivin,BMPを含むTGF-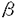 superfamilyの一種であり、細胞の増殖、分化、接着などの制御に関連し様々な生理作用を示すサイトカインである。TGF- superfamilyの一種であり、細胞の増殖、分化、接着などの制御に関連し様々な生理作用を示すサイトカインである。TGF-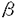 のシグナル伝達系に関しては近年、Smad,TAKという2種類の細胞内シグナル伝達物質の発見により飛躍的に進歩している。TGF- のシグナル伝達系に関しては近年、Smad,TAKという2種類の細胞内シグナル伝達物質の発見により飛躍的に進歩している。TGF-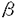 の受容体にはTypeI,TypeIIの2種類の膜貫通型セリン/スレオニンキナーゼが知られている。TGF- の受容体にはTypeI,TypeIIの2種類の膜貫通型セリン/スレオニンキナーゼが知られている。TGF-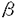 が受容体に結合するとTypeI,TypeII receptorは細胞表面で複合体を形成する。さらにTypeII receptorがTypeI receptorのGS領域をリン酸化することによってTypeI receptorが活性化し細胞内にTGF- が受容体に結合するとTypeI,TypeII receptorは細胞表面で複合体を形成する。さらにTypeII receptorがTypeI receptorのGS領域をリン酸化することによってTypeI receptorが活性化し細胞内にTGF-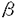 のシグナルが伝えられていく。活性化したTypeI receptorがどのようにシグナルを下流に伝えるのかについては現在までにSmad pathway,TAK pathwayという2種の異なる経路の存在が報告されている。 のシグナルが伝えられていく。活性化したTypeI receptorがどのようにシグナルを下流に伝えるのかについては現在までにSmad pathway,TAK pathwayという2種の異なる経路の存在が報告されている。 TAK1は新規のMAPKKKに属する分子として同定され、そのキナーゼ活性はTGF-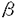 によって上昇することが示されている。活性化したTypeI receptorはまず、TAK1のactivatorであるTAB1にシグナルを伝え、TAB1によって活性化したTAK1がMKK3/4/6→p38へとkinase cascadeを誘導していく。TAK1経路が最終的に核内のどんな因子にシグナルを伝達しているのかについては現在までは不明である。 によって上昇することが示されている。活性化したTypeI receptorはまず、TAK1のactivatorであるTAB1にシグナルを伝え、TAB1によって活性化したTAK1がMKK3/4/6→p38へとkinase cascadeを誘導していく。TAK1経路が最終的に核内のどんな因子にシグナルを伝達しているのかについては現在までは不明である。 一方、Smadは、DrosophilaにおいてmammalのBMP2/4に相当するdppの下流因子としてgenetic screeningによって得られたDrosophila Madのmammmalian homologueである。Smad3は活性化したTypeI receptorによって直接的にそのC末端がリン酸化される。リン酸化されたSmad3はactivin,TGF-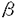 ,BMPシグナルの共通のmediatorであるSmad4と複合体を形成し核内に移動する。核内においてSmad complexは核内転写因子と結合しTGF- ,BMPシグナルの共通のmediatorであるSmad4と複合体を形成し核内に移動する。核内においてSmad complexは核内転写因子と結合しTGF-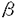 のtarget geneの誘導を引き起こすことが予想されるが標的核内因子については現在までにほとんど知られていない。 のtarget geneの誘導を引き起こすことが予想されるが標的核内因子については現在までにほとんど知られていない。 以上のようにTAK,Smad両経路の存在は報告されているが、この2つの経路の関係や、核内標的因子などについては明らかにはなっていない。本研究によりATF-2がTAK,Smad両経路の共通の核内標的因子であり2つの経路によって別々に生じたTGF-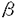 signalを増幅させていることが明らかとなった。私はATF-2がp38の基質であることやTGF- signalを増幅させていることが明らかとなった。私はATF-2がp38の基質であることやTGF-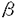 のtarget geneの制御領域内に存在するTGF- のtarget geneの制御領域内に存在するTGF-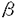 response elementにはCRE/TREが多く含まれることからATF-2とTGF- response elementにはCRE/TREが多く含まれることからATF-2とTGF-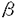 signalとの関係に注目し実験を行ったところ、TGF- signalとの関係に注目し実験を行ったところ、TGF-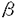 によって活性化したTAK1がMKK3/4/6→p38へとリン酸化シグナルを伝達し最終的にp38がATF-2のN端をリン酸化してATF-2の転写活性化能を上昇させること、さらにSmad3/4 complexが核内でATF-2と複合体を形成し、その制御領域にCREを含むTGF- によって活性化したTAK1がMKK3/4/6→p38へとリン酸化シグナルを伝達し最終的にp38がATF-2のN端をリン酸化してATF-2の転写活性化能を上昇させること、さらにSmad3/4 complexが核内でATF-2と複合体を形成し、その制御領域にCREを含むTGF-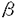 signalのtarget geneの転写を誘導することを見い出した。興味深いことにこのTAK,Smad両経路によるTGF- signalのtarget geneの転写を誘導することを見い出した。興味深いことにこのTAK,Smad両経路によるTGF-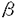 dependentなATF-2の活性化は同時に協調的に起こることも明らかになった。以上から、ATF-2はTAK,Smad両経路による2つのTGF- dependentなATF-2の活性化は同時に協調的に起こることも明らかになった。以上から、ATF-2はTAK,Smad両経路による2つのTGF-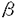 signalを1つに統合、増幅するというTGF- signalを1つに統合、増幅するというTGF-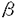 signalにおいて重要な役割を担っている転写因子であることが示された。 signalにおいて重要な役割を担っている転写因子であることが示された。 |