本研究は、脳の発達過程および神経可塑性に重要な役割を果たしていると考えられている、N-Methyl-D-Aspartate(NMDA)型グルタミン酸受容体の制御機構を明らかにするために、NMDA受容体に直接相互作用する蛋白質の同定を試みたものであり、下記の結果を得ている。 1、Yeast two-hybridスクリーニング法を用いてNMDA受容体のNR1サブユニットのCOOH末端に相互作用する分子としてCalmodulin(CaM)を同定した。CaMは、カルシウム依存的にNR1のCOOH末端のC1領域に結合し、NMDA ChannelのOpen Channel Probabilityを約50%減少させることを明らかにした。さらに、CaMとNR1の相互作用は、代謝型グルタミン酸受容体活性化によるProtein kinase C(PKC)を介したNR1のリン酸化により妨げられることを示した。 2、NMDAR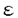 2サブユニットのチロシンリン酸基が、Src homology2(SH2)domainを有する分子と相互作用しシグナルを送ることを想定し、NMDAR 2サブユニットのチロシンリン酸基が、Src homology2(SH2)domainを有する分子と相互作用しシグナルを送ることを想定し、NMDAR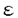 2のチロシンリン酸化依存的に結合する分子のスクリーニングを行った。NMDAR 2のチロシンリン酸化依存的に結合する分子のスクリーニングを行った。NMDAR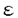 2のCOOH末端とGSTとの融合蛋白質を試験管内でSrc kinaseによりリン酸化したものをBaitとして脳抽出液から相互作用する分子を共沈したところ、PI3-kinaseの制御サブユニットのp85が相互作用することを明らかにした。また、NMDAR 2のCOOH末端とGSTとの融合蛋白質を試験管内でSrc kinaseによりリン酸化したものをBaitとして脳抽出液から相互作用する分子を共沈したところ、PI3-kinaseの制御サブユニットのp85が相互作用することを明らかにした。また、NMDAR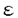 2のチロシンリン酸化に、Fyn kinaseが関わっていることを培養細胞系において明らかにし、実際、FynノックアウトマウスにおけるNMDAR 2のチロシンリン酸化に、Fyn kinaseが関わっていることを培養細胞系において明らかにし、実際、FynノックアウトマウスにおけるNMDAR 2のチロシンリン酸化が著明に減少しており、p85の相互作用が減少していることを示した。さらに、虚血時のNMDAR 2のチロシンリン酸化が著明に減少しており、p85の相互作用が減少していることを示した。さらに、虚血時のNMDAR 2のチロシンリン酸化の上昇に伴い、NMDAR 2のチロシンリン酸化の上昇に伴い、NMDAR 2とp85の相互作用が増加することを示した。 2とp85の相互作用が増加することを示した。 以上、本論文はNMDA受容体に相互作用する分子としてCaMとPI3-kinasseを同定した。CaMがNR1に直接相互作用することでNMDAチャネルを不活性化することを示したことは、NMDAチャネルの活性制御機構の一端を明らかにしたと考えられる。また本論文は、チャネルであるNMDA受容体が、NMDAR 2のリン酸化チロシンを介してPI3-kinaseにシグナルを伝えることを示唆し、チャネルのリン酸化チロシンの新しい意義を明らかにしたといえる。本論文は、中枢神経系におけるNMDA受容体の活性制御、役割の解明に重要な貢献を為すと考えられ、学位の授与に値するものと考えられる。 2のリン酸化チロシンを介してPI3-kinaseにシグナルを伝えることを示唆し、チャネルのリン酸化チロシンの新しい意義を明らかにしたといえる。本論文は、中枢神経系におけるNMDA受容体の活性制御、役割の解明に重要な貢献を為すと考えられ、学位の授与に値するものと考えられる。 |