本研究は、チロシンキナーゼ系の下流で働くアダプター蛋白質であるAsh/Grb2の細胞骨格系への影響を明らかにするために、Ash/Grb2結合蛋白質をウシ大脳から精製し、その結合蛋白質が細胞骨格系にどう関与しているかを解析したものであり、以下の結果を得ている。 1.Ash/Grb2結合蛋白質を同定する目的で、Ash/Grb2とグルタチオン-S-トランスフェラーゼ(GST)との融合蛋白質であるGST-Ash/Grb2をグルタチオンビーズに結合させてAsh/Grb2-アフィニティーカラムを作成した。このAsh/Grb2-アフィニティーカラムにウシ大脳細胞質画分をかけたところ、Ash/Grb2に特異的に結合する蛋白質が4つ認められた。そのうち、SDS-PAGE上、分子量が約150kDaの蛋白質(p150)を精製してその一次構造を決定したところ、ラットシナプトジャニンのウシホモログであった。 2.シナプトジャニンは、SAC1相同領域、OCRL相同領域、プロリンに富む領域を有している。SAC1は分泌とアクチン細胞骨格を制御していると考えられており、OCRLは伴性劣性遺伝を示すLowe症候群の原因遺伝子産物であり、PIP2ホスファターゼ活性を有することが明らかになっている。そこで、シナプトジャニンの生化学的性状について検討した。シナプトジャニンは、SAC1相同領域とOCRL相同領域を介してアクチンに結合し、プロリンに富む領域を介してAsh/Grb2が結合した。シナプトジャニンは、OCRLと同様PIP2ホスファターゼ活性を有していた。 3.シナプトジャニンをCOS7細胞に発現させたところ、アクチンストレスファイバーが消失して多核になり細胞膜辺縁にリング状のラッフルズが認められた。 4.シナプトジャニンを発現しているCOS7細胞にEGF刺激を加えると、ラッフルズが増強し、シナプトジャニンはEGF刺激依存性にAsh/Grb2を介してEGF受容体に結合した。しかし、シナプトジャニンのホスファターゼ活性欠損変異体を発現しているCOS7細胞では、そのような変化は認められなかった。 5.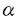 -アクチニンによるF-アクチンの線維束形成におよぼすシナプトジャニンの影響をfalling ball assayにて検討したところ、シナプトジャニンは -アクチニンによるF-アクチンの線維束形成におよぼすシナプトジャニンの影響をfalling ball assayにて検討したところ、シナプトジャニンは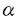 -アクチニンによるF-アクチンの線維束形成を阻害した。また、シナプトジャニンのPIP2ホスファターゼ活性に対するアクチン調節蛋白質の影響を検討したところ、シナプトジャニンのPIP2ホスファターゼ活性は -アクチニンによるF-アクチンの線維束形成を阻害した。また、シナプトジャニンのPIP2ホスファターゼ活性に対するアクチン調節蛋白質の影響を検討したところ、シナプトジャニンのPIP2ホスファターゼ活性は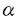 -アクチニンなどのアクチン調節蛋白質によって変化しなかった。 -アクチニンなどのアクチン調節蛋白質によって変化しなかった。 以上、本論文は、アクチン調節蛋白質に結合したPIP2を分解する細胞内情報伝達系として、受容体型チロシンキナーゼ-Ash/Grb2-シナプトジャニン系が存在し、この細胞内情報伝達系においてシナプトジャニンの有するPIP2ホスファターゼ活性がアクチン細胞骨格の再編成の制御に重要であることを明らかにした。本研究は、受容体型チロシンキナーゼ系の下流に存在する新たなアクチン細胞骨格の制御機構を見い出したものであり、チロシンキナーゼ系の細胞内情報伝達系の研究に重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 |