ホスホリパーゼC(PLC)は、ホスファチジルイノシトール-4,5-ビスリン酸(PIP2)を加水分解して、イノシトール-1,4,5-三リン酸(IP3)およびジアシルグリセロール(DAG)を産生する酵素である。受容体刺激によるPLCの活性化により産生されたIP3は細胞内カルシウム濃度を上昇させ、DAGはPKCを活性化する。この経路はイノシトールリン脂質シグナリングにおける一つの主要なシグナル伝達経路として知られており、イノシトールリン酸ホスファターゼによるIP3の脱リン酸化およびDAGキナーゼによるDAGのリン酸化がこのシグナル伝達経路を終了させると考えられている。しかしながら、PLCによって2つのシグナルは同時に伝わるので、これらの経路を同時に終了させるもの、すなわちPLCの負の制御機構も存在する可能性が示唆される。 PLC 4は発現している組織や細胞が限局されており、増殖因子などの刺激によって、発現が誘導されるといった特徴を持つ。またALTI、ALTIIという2つのスプライシングアイソフォームが存在することも知られている。本研究ではこうしたスプライシングアイソフォームの存在意義を解明するため、PLC 4は発現している組織や細胞が限局されており、増殖因子などの刺激によって、発現が誘導されるといった特徴を持つ。またALTI、ALTIIという2つのスプライシングアイソフォームが存在することも知られている。本研究ではこうしたスプライシングアイソフォームの存在意義を解明するため、PLC 4の活性制御機構にどう関与しているかを解析することを試みた。まず別の新たなアイソフォームの存在を検討した。5’末端および3’末端の非翻訳領域の配列をもとにプライマーを作製し、PLC 4の活性制御機構にどう関与しているかを解析することを試みた。まず別の新たなアイソフォームの存在を検討した。5’末端および3’末端の非翻訳領域の配列をもとにプライマーを作製し、PLC 4の発現量が多い精巣のtotal RNAをテンプレートとして、RT-PCRを行い、シーケンス解析した。その結果、今までに報告されているPLC 4の発現量が多い精巣のtotal RNAをテンプレートとして、RT-PCRを行い、シーケンス解析した。その結果、今までに報告されているPLC 4,ALTI,ALTIIの他に新しいアイソフォームをコードするクローンを得ることができた(ALTIII)。ALTIおよびALTIIは、触媒領域であるXドメインとYドメインの間のリンカー部位に32アミノ酸および14アミノ酸がそれぞれ挿入されているのに対し、ALTIIIでは触媒領域のXドメインの後半から、リンカー部位をほとんど含む63アミノ酸がALTIの32アミノ酸からなる挿入配列に置き換わっていた。これまでにも、PLCの中でスプライシングアイソフォームを持つものとして、ショウジョウバエのPLCであるnorpAやplc21、またPLC 4,ALTI,ALTIIの他に新しいアイソフォームをコードするクローンを得ることができた(ALTIII)。ALTIおよびALTIIは、触媒領域であるXドメインとYドメインの間のリンカー部位に32アミノ酸および14アミノ酸がそれぞれ挿入されているのに対し、ALTIIIでは触媒領域のXドメインの後半から、リンカー部位をほとんど含む63アミノ酸がALTIの32アミノ酸からなる挿入配列に置き換わっていた。これまでにも、PLCの中でスプライシングアイソフォームを持つものとして、ショウジョウバエのPLCであるnorpAやplc21、またPLC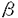 1,PLC 1,PLC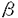 4などが報告されているが、これらは全て、触媒領域の外でスプライシングによる変化が起きている。従って、ALTIIIは触媒領域の中でスプライシングによる変化が起こっている初めての例である。 4などが報告されているが、これらは全て、触媒領域の外でスプライシングによる変化が起きている。従って、ALTIIIは触媒領域の中でスプライシングによる変化が起こっている初めての例である。 ALTIIIの発現量はほとんどの組織、細胞においてPLC 4に比べて低いが、マウス神経芽腫細胞であるN1E-115細胞においては顕著に高く、またマウス胚性腫瘍細胞であるp19においては、通常、発現量は低いが、レチノイン酸で神経細胞に分化させたものでは顕著にその発現量が高くなっていた。このことからALTIIIはある種のがん化した神経細胞で特異的な役割を果たしていることが示唆される。 4に比べて低いが、マウス神経芽腫細胞であるN1E-115細胞においては顕著に高く、またマウス胚性腫瘍細胞であるp19においては、通常、発現量は低いが、レチノイン酸で神経細胞に分化させたものでは顕著にその発現量が高くなっていた。このことからALTIIIはある種のがん化した神経細胞で特異的な役割を果たしていることが示唆される。 ALTIIIが触媒領域にスプライシングを受けていることから予想されるように、ALTIIIは実際に酵素活性を持っていなかった。またCOS7細胞に過剰発現させたPLC 4の酵素活性は、ALTIIIを共発現させることによって阻害された。一方、これまでに単離されているALTIやALTIIでは阻害されなかった。 4の酵素活性は、ALTIIIを共発現させることによって阻害された。一方、これまでに単離されているALTIやALTIIでは阻害されなかった。 また、in vivoにおいても同様の阻害効果がみられるのかを解析するため、レトロウイルスによる発現系を用いて、NIH3T3細胞にPLC 4を過剰発現することによるIP3量の増加がALTIIIの共発現によって阻害されるかどうかを検討した。その結果、ALTIIIはin vivoにおいてもPLC 4を過剰発現することによるIP3量の増加がALTIIIの共発現によって阻害されるかどうかを検討した。その結果、ALTIIIはin vivoにおいてもPLC 4の活性を阻害することが見い出された。さらに、この阻害効果はPHドメインを単独で発現させただけでも完全に抑制されたが、PHドメインを欠いた変異体では、全く阻害されなかった。このことから、ALTIIIによる阻害作用にはPHドメインが必要かつ十分であることが示された。 4の活性を阻害することが見い出された。さらに、この阻害効果はPHドメインを単独で発現させただけでも完全に抑制されたが、PHドメインを欠いた変異体では、全く阻害されなかった。このことから、ALTIIIによる阻害作用にはPHドメインが必要かつ十分であることが示された。 PHドメインはイノシトールリン脂質に結合することによって、膜へ局在させる働きを持つことが知られており、PHドメインをもつタンパク質が機能する上で非常に重要な役割を担っている。また、さまざまなタンパク質のPHドメインはそれぞれ異なったイノシトールリン脂質に対する結合の特異性を持っており、その特異性の違いによって、いくつかのグループに分けられる。例えば、PLC 1のPHドメインはPIP2,IP3に選択的に結合し、PIP2との結合によって膜へ局在することで活性化し、IP3との結合によって膜から離れて、不活化することが知られている。ALTIIIのPHドメインによるPLC活性の阻害にもイノシトールリン脂質との結合が重要であると考えられたので、次にALTIIIPHドメインのイノシトールリン脂質およびイノシトールリン酸に対する結合能を検討した。ALTIIIのPHドメインをコードするGST融合組み換えタンパク質を大腸菌を用いて発現させて、解析したところ、PIP2およびPIP3に対して選択的に結合することが明らかとなった。一方、PI,PIP,IP3,IP4に対しては全く結合しなかった。従って、ALTIIIによるPLC活性の阻害はPHドメインを介したPIP2との結合による競合的な阻害によるものである可能性が考えられた。実際、バキュロウイルスを用いて発現させたPLC 1のPHドメインはPIP2,IP3に選択的に結合し、PIP2との結合によって膜へ局在することで活性化し、IP3との結合によって膜から離れて、不活化することが知られている。ALTIIIのPHドメインによるPLC活性の阻害にもイノシトールリン脂質との結合が重要であると考えられたので、次にALTIIIPHドメインのイノシトールリン脂質およびイノシトールリン酸に対する結合能を検討した。ALTIIIのPHドメインをコードするGST融合組み換えタンパク質を大腸菌を用いて発現させて、解析したところ、PIP2およびPIP3に対して選択的に結合することが明らかとなった。一方、PI,PIP,IP3,IP4に対しては全く結合しなかった。従って、ALTIIIによるPLC活性の阻害はPHドメインを介したPIP2との結合による競合的な阻害によるものである可能性が考えられた。実際、バキュロウイルスを用いて発現させたPLC 4,ALTIIIタンパク質あるいは大腸菌を用いて発現させたALTIIIPHドメイン,X-Yドメイン,さらにPIP2に対する親和性が低いALTIIIPHの変異体R36Gを用いて、in vitroにおける阻害効果を検討したところ、in vivoの結果と同様、ALTIIIおよびALTIIIPHがPLC 4,ALTIIIタンパク質あるいは大腸菌を用いて発現させたALTIIIPHドメイン,X-Yドメイン,さらにPIP2に対する親和性が低いALTIIIPHの変異体R36Gを用いて、in vitroにおける阻害効果を検討したところ、in vivoの結果と同様、ALTIIIおよびALTIIIPHがPLC 4の酵素活性を阻害したが、一方でR36G変異体は全く阻害しなかった。このことからALTIIIの阻害作用にはPHドメインへのPIP2の結合が、必要不可欠であることが明らかとなった。 4の酵素活性を阻害したが、一方でR36G変異体は全く阻害しなかった。このことからALTIIIの阻害作用にはPHドメインへのPIP2の結合が、必要不可欠であることが明らかとなった。 さらに、ALTIIIが他のPLCを阻害するかについて検討した。まず、牛脳から精製したPLC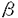 1, 1,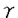 1, 1, 1を用いてin vitroにおける阻害効果を解析したところ、PLC 1を用いてin vitroにおける阻害効果を解析したところ、PLC 1の活性を阻害し、PLC 1の活性を阻害し、PLC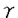 1の活性を若干抑制し、PLC 1の活性を若干抑制し、PLC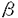 1に対しては影響がないことが見い出された。。このことから、ALTIIIはPLC 1に対しては影響がないことが見い出された。。このことから、ALTIIIはPLC タイプを特異的に阻害することが明らかになった。PLCのアイソザイムによって感受性が異なることから、ALTIIIによる阻害は単に基質としてのPIP2を競合的に阻害することによるものではないと考えられる。各アイソザイムに対する阻害効果の違いは、おのおののPHドメインのPIP2結合能を反映している。すなわち、PLC タイプを特異的に阻害することが明らかになった。PLCのアイソザイムによって感受性が異なることから、ALTIIIによる阻害は単に基質としてのPIP2を競合的に阻害することによるものではないと考えられる。各アイソザイムに対する阻害効果の違いは、おのおののPHドメインのPIP2結合能を反映している。すなわち、PLC 1はPIP2に対する親和性が高く、PLC 1はPIP2に対する親和性が高く、PLC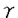 1はPIP2よりもPIP3に親和性が高い。一方、PLC 1はPIP2よりもPIP3に親和性が高い。一方、PLC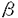 1はイノシトールリン脂質に対する結合の特異性がない。従って、ALTIIIは、おそらくPHドメインにPIP2が結合することによるPLC 1はイノシトールリン脂質に対する結合の特異性がない。従って、ALTIIIは、おそらくPHドメインにPIP2が結合することによるPLC 1の活性化を主に阻害しているのであろう。言い換えれば、PLC 1の活性化を主に阻害しているのであろう。言い換えれば、PLC 1のPIP2依存的な活性化機構がALTIIIに対する高い感受性を生み出しているのであろう。 1のPIP2依存的な活性化機構がALTIIIに対する高い感受性を生み出しているのであろう。 次にin vivoにおいても同様の結果が得られるか検討するため、レトロウイルスを用いて、NIH3T3細胞にPLC 1を過剰発現させ、これに対するALTIIIの共発現の影響を調べたところ、PLC 1を過剰発現させ、これに対するALTIIIの共発現の影響を調べたところ、PLC 1を過剰発現させることによるIP3量の増加はALTIIIにより阻害されることが見い出された。このことから、ALTIIIはPLC 1を過剰発現させることによるIP3量の増加はALTIIIにより阻害されることが見い出された。このことから、ALTIIIはPLC 1の酵素活性をin vitroおよびin vivoどちらにおいても阻害することが明らかとなった。一方、PLC 1の酵素活性をin vitroおよびin vivoどちらにおいても阻害することが明らかとなった。一方、PLC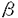 を活性化することが知られている、ブラジキニンあるいはPLC を活性化することが知られている、ブラジキニンあるいはPLC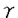 を活性化することが知られている血小板由来増殖因子(PDGF)の刺激によるIP3量の増加が、ALTIIIの過剰発現によって抑制されるかどうか検討したところ、in vitroの結果とは対象的に、ALTIIIはブラジキニン、PDGF刺激によるPLCの活性化を抑制した。in vitroにおける結果から、ALTIIIがPLC を活性化することが知られている血小板由来増殖因子(PDGF)の刺激によるIP3量の増加が、ALTIIIの過剰発現によって抑制されるかどうか検討したところ、in vitroの結果とは対象的に、ALTIIIはブラジキニン、PDGF刺激によるPLCの活性化を抑制した。in vitroにおける結果から、ALTIIIがPLC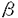 および および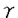 を直接阻害することは考えにくいため、in vivoにおける抑制は、間接的にこれらのPLCに影響を与えた結果であろう。すなわち、PIP2依存的に膜へ局在する分子がALTIIIにより阻害され、結果としてこれらのPLCの活性を抑制したものと推察できる。以上の結果より、本研究においてPLC を直接阻害することは考えにくいため、in vivoにおける抑制は、間接的にこれらのPLCに影響を与えた結果であろう。すなわち、PIP2依存的に膜へ局在する分子がALTIIIにより阻害され、結果としてこれらのPLCの活性を抑制したものと推察できる。以上の結果より、本研究においてPLC 4の新規スプライシングアイソフォームALTIIIはPLCを直接あるいは間接的に負に制御する因子として働き、その作用にはPHドメインが必要不可欠であることが示された。ALTIIIの発現パターンから、この働きはある種の神経細胞に特異的に起こっている現象であると推察できる。 4の新規スプライシングアイソフォームALTIIIはPLCを直接あるいは間接的に負に制御する因子として働き、その作用にはPHドメインが必要不可欠であることが示された。ALTIIIの発現パターンから、この働きはある種の神経細胞に特異的に起こっている現象であると推察できる。 |