【方法と結果】 MC-1 fibrosarcoma細胞(5×105個)を8週齢のC57BL/6マウスへ尾静脈より注射した。14日後に解剖し、転移結節のできた肺を無菌的に摘出し、total RNAを抽出した。それとは別に、正常肺、および培養MC-1細胞よりtotal RNAを抽出した。これら3つのサンプル間でDifferential Displayを行い、癌転移に伴って発現変化する遺伝子の探索を試みた。
現在までに52種類のプライマーセットを用いることによりDifferential Display上で異なる泳動パターンを示す42個のDNA断片を検出できた。それらの中で13個のDNA断片をサブクローニングした後、塩基配列を決定し、ホモロジー検索を行った。その結果、既知遺伝子と一致したクローンが5個存在し、それらはc-met proto-oncogene、proliferating cell nuclear antigen (PCNA)、lysosomal sialidase、Rhoatekin、NADH oxidoreductase subunit MWFEと一致していた。また、ヒトやラットと相同性の高かったクローンが4個存在し、それらはHuman nebulin(約90%)、Human Rab5c like protein (約80%)、Rat mitochondrial proton/phosphate symporter(約90%)、Rat 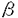 -globin(約83%)であった。その他のクローンについては2個の遺伝子がマウスのESTと一致し、残りの2個の遺伝子が新規遺伝子であった。
-globin(約83%)であった。その他のクローンについては2個の遺伝子がマウスのESTと一致し、残りの2個の遺伝子が新規遺伝子であった。
それらのクローンのうち、c-met、PCNA、lysosomal sialidase、Rhotekin、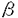 -globinおよびマウスのESTと一致した遺伝子について、ノーザンブロット解析により転移巣における発現の変化を検討した。その結果c-metおよびlysosomal sialidaseは正常肺での発現は低く、MC-1細胞には発現が認められたが、転移巣においてその発現の上昇が認められた。また、PCNAおよびRhotekinはMC-1細胞において発現が高く、転移巣においては発現が低下しており、正常肺では発現がほとんど認められなかった。また、
-globinおよびマウスのESTと一致した遺伝子について、ノーザンブロット解析により転移巣における発現の変化を検討した。その結果c-metおよびlysosomal sialidaseは正常肺での発現は低く、MC-1細胞には発現が認められたが、転移巣においてその発現の上昇が認められた。また、PCNAおよびRhotekinはMC-1細胞において発現が高く、転移巣においては発現が低下しており、正常肺では発現がほとんど認められなかった。また、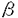 -globinは正常肺において発現が高く、転移巣においては発現が低下しており、MC-1細胞では発現がほとんど認められなかった。なお、これらの中でDifferential Display上のパターンとノーザンブロット解析による結果が一致したものはc-met、Rhotekin、および
-globinは正常肺において発現が高く、転移巣においては発現が低下しており、MC-1細胞では発現がほとんど認められなかった。なお、これらの中でDifferential Display上のパターンとノーザンブロット解析による結果が一致したものはc-met、Rhotekin、および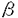 -globinであり、PCNA、lysosomal sialidaseは一致しなかった。また、マウスのESTと一致した2つのクローンについては、ノーザンブロットによる解析においては、その発現は検出できなかった。その他のクローンについては、ノーザンブロット解析による発現変化の検討は行っておらず、今後検討していく予定である。
-globinであり、PCNA、lysosomal sialidaseは一致しなかった。また、マウスのESTと一致した2つのクローンについては、ノーザンブロットによる解析においては、その発現は検出できなかった。その他のクローンについては、ノーザンブロット解析による発現変化の検討は行っておらず、今後検討していく予定である。
c-met遺伝子はHGF/SFの受容体をコードしており、リガンドであるHGF/SFが増殖促進に加え、抗アポトーシス活性、細胞の遊走促進、形態形成誘導活性、血管新生因子としても機能する多機能因子であることから、転移巣におけるc-met遺伝子の過剰発現は癌転移と何らかの相関性を持つ可能性が強く示唆されたた。そのため、本研究では癌転移に伴うc-met遺伝子の発現変化について、より詳細な解析を試みた。
転移巣におけるc-met遺伝子の過剰発現の部位を検討するために、肺転移巣の組織切片を作成し、抗c-Met抗体による免疫染色およびin situ hybridizationを行った。その結果、c-met遺伝子の発現は腫瘍細胞に認められた。
リガンドであるHGF/SFがc-Metに結合すると、c-MetのC末端近傍のチロシン残基の自己リン酸化が引き起こされ、各種細胞内情報伝達系が活性化されることが知られていため、c-Metが転移巣で活性化されているか否かを検討した。正常肺、転移肺およびMC-1細胞より調製したcell lysatesに対し、抗c-Met抗体により免疫沈降した後、抗c-Met抗体あるいは抗リン酸化チロシン抗体によりイムノブロット解析を行った。その結果、タンパク質レベルでもc-Metの量は上昇しており、また、c-MetはMC-1細胞ではチロシンリン酸化されていないのに対し、正常肺および転移巣においてc-Metのチロシンリン酸化が認められた。
次に、転移巣におけるc-met遺伝子の過剰発現がMC-1細胞の集団の中でc-met遺伝子を発現している細胞が選択された結果であるのか、あるいは、転写レベルでその発現が誘導されているのかを検討した。転移結節のある肺を無菌的に摘出した後、転移巣の腫瘍細胞を再び培養した(L1-MC-1細胞)。さらに、L1-MC-1細胞を同様にしてマウスに尾静脈注射後、転移巣の腫瘍細胞を培養した(L2-MC-1細胞)。これらの細胞のc-met遺伝子の発現をノーザンブロット解析により検討したところ、これらの細胞のc-met遺伝子の発現量はMC-1細胞とほぼ同程度であった。このことより、転移巣におけるc-met遺伝子の過剰発現は、転写レベルで制御されていることが示唆された。
また、転移巣におけるc-met遺伝子の過剰発現がMC-1細胞に特異的な現象かどうか検討するために、B16メラノーマ細胞を用いて同様の実験を行ったところ、MC-1細胞を用いた場合と同様に転移巣においてc-met遺伝子の過剰発現が認められた。このことから、転移巣におけるc-met遺伝子の過剰発現がMC-1細胞だけに見られる現象ではないことが示された。
c-met遺伝子の発現誘導がIL-1、IL-6、TNF-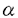 あるいはTGF-
あるいはTGF-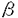 によって誘導されるという報告があったため、転移巣におけるそれらの発現をRT-PCR法によって検討したところ、それらの発現は転移巣において認められ、特にTNF-
によって誘導されるという報告があったため、転移巣におけるそれらの発現をRT-PCR法によって検討したところ、それらの発現は転移巣において認められ、特にTNF-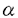 においては転移巣において過剰発現していることが明らかとなった。
においては転移巣において過剰発現していることが明らかとなった。
【考察】 本研究ではDifferential Display法を用いて、転移巣において発現変化している遺伝子クローニングを試み、シークエンスおよびホモロジー検索を行うことにより、その候補となる遺伝子をいくつかクローニングすることに成功した。lysosomal sialidaseはシアル酸の量を制御していることが明かとなっているが、細胞の癌化時にシアル酸の質的および量的変化が、癌細胞の浸潤・転移能と関連していることが示唆されており、転移巣における発現変化は興味深い。また、Rhotekinはtwo-hybrid screeningによりRhoA、RhoB、およびRhoCの標的タンパク質をコードする遺伝子として単離・同定された遺伝子であり、Rhoが細胞運動、細胞接着、癌細胞の浸潤・転移に関与していることからも、Rhotekinの転移巣における発現変化も興味深い。このようにクローニングされた遺伝子の中には、癌転移と関連が示唆されている遺伝子も存在したが、その他の遺伝子については癌転移との関連は必ずしも強くなく、今後の解析が必要である。
c-met遺伝子は胃癌、肝臓癌、大腸癌、甲状腺癌などの癌組織で過剰発現が起こり、癌の進行に深く関わっていることが示唆されており、また、ここ数年来の研究からHGF/SFが臓器組織の間葉系細胞で産生され、癌-間質相互作用のメディエーターとして様々な癌の悪性化に関与することが明らかにされていたため、癌転移との関連が強く示唆された。HGF/SFが正常肺に発現しており、転移肺の癌組織でc-met遺伝子の過剰発現およびc-Metの自己リン酸化が認められたことから、HGF/SF-Metのシグナルが癌の肺転移と何らかの関与がある可能性ある。正常組織におけるHGF/SFの発現が、肺、腎臓および肝臓で比較的多いことは、癌転移の臓器特異性とc-met遺伝子の発現変化との相関性がある可能性があり、今後の検討が必要である。
c-met遺伝子の発現誘導が、IL-1、IL-6、TNF-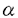 あるいはTGF-
あるいはTGF-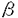 によって引き起こされる誘導するという報告があり、転移肺においてこれらのサイトカインの発現が認められたことは興味深い。特にTNF-
によって引き起こされる誘導するという報告があり、転移肺においてこれらのサイトカインの発現が認められたことは興味深い。特にTNF-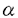 が転移巣において過剰発現していたことより、肺の転移巣におけるc-metの過剰発現がTNF-
が転移巣において過剰発現していたことより、肺の転移巣におけるc-metの過剰発現がTNF-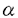 と関連している可能性がある。
と関連している可能性がある。
転移巣におけるc-met遺伝子の過剰発現がMC-1細胞特異的な現象ではなく、B16メラノーマ細胞にも認められたことから、転移巣においてc-met遺伝子の過剰発現は癌転移に重要な役割を果たす可能性が示唆された。