本研究は哺乳動物中枢神経系において重要な役割を演じていると考えられているプロトカドヘリン(Pcdh)の機能を明らかにするため、新規Pcdh様遺伝子としてBH-PcdhのヒトおよびマウスcDNAの単離を行い、細胞内領域における結合タンパク質の同定を含めた機能解析を試みたものであり、下記の結果を得ている。 1.ヒト胃癌細胞MKN28において顕著な発現を示す膜タンパク質を単離する過程において脳および心臓で強い発現を示し、Pcdh1に対して46-49%の相同性を示す新規Pcdh様遺伝子BH-PcdhのヒトcDNAを得た。ヒトおよびマウスBH-Pcdhは相互に97%の相同性を示し、細胞内領域末端においてヒトでは3つ(a、bおよびc)、マウスでは4つのアイソフォームを保持している事が示された。 2.発生における各アイソフォームの発現変化を調べる目的でマウス心臓(1および5週齢)および脳(18日齢胎児、1および5週齢)についてRT-PCRを行ったところ、BH-Pcdh-aおよび-cで発現は持続的に強く発生による変化は認められなかったが、BH-Pcdh-bでは胎生から新生期の脳においてのみ発現が増強している事が示された。 3.ヒトおよびマウスBH-Pcdh遺伝子はそれぞれ4p15および5C3-D領域にマッピングされ、相互にシンテニーのある領域である事が示された。またゲノムサザンブロットよりBH-Pcdhは酵母では検出されなかったが、脊椎動物に広くsingle copy geneとして存在している事が示された。 4.マウスL細胞へ各アイソフォームを強制発現させたところ、それぞれ特徴的な形態を示しBH-Pcdh-a発現細胞はカルシウム依存的な細胞凝集塊を形成する事が示された。BH-Pcdh-aおよび-cに対する抗体と発現細胞を用いたWestern blotの結果、分子量はそれぞれ約140および160kDaである事が示された。 5.BH-Pcdh-c細胞内領域結合タンパク質同定のためyeast two-hybrid screeningを行ったところ、ヒト脳cDNAライブラリーからプロテインフォスファターゼ1alpha(PP1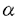 )、新規G-protein様タンパク質およびPDZドメインを含むタンパク質などが得られた。Pull-down assayにおいてPP1 )、新規G-protein様タンパク質およびPDZドメインを含むタンパク質などが得られた。Pull-down assayにおいてPP1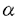 とBH-Pcdh-c細胞内領域はBH-Pcdh-cのPP1結合モチーフ依存的に結合し、またBH-Pcdh-c発現細胞およびMKN28細胞を用いた免疫沈降より両タンパク質は結合している可能性が高いと考えられた。 とBH-Pcdh-c細胞内領域はBH-Pcdh-cのPP1結合モチーフ依存的に結合し、またBH-Pcdh-c発現細胞およびMKN28細胞を用いた免疫沈降より両タンパク質は結合している可能性が高いと考えられた。 6.グリコーゲンフォスフォリラーゼに対するPP1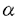 の脱リン酸化活性はBH-Pcdh-c細胞内領域によって抑制(IC50=〜10nM)されたが、ミエリン塩基性タンパク質に対しては有意に抑制されなかった。 の脱リン酸化活性はBH-Pcdh-c細胞内領域によって抑制(IC50=〜10nM)されたが、ミエリン塩基性タンパク質に対しては有意に抑制されなかった。 7.In situ hybridizationおよび免疫染色よりBH-Pcdh-c mRNAはマウス大脳皮質の神経細胞に局在しており、PP1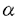 と共にシナプス可塑性に関与している可能性が示唆された。 と共にシナプス可塑性に関与している可能性が示唆された。 以上、本論文は新規Pcdh様遺伝子BH-Pcdhのアイソフォームの一つがその細胞内領域においてPP1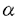 と結合し、大脳皮質神経細胞に局在している事を明らかとした。本研究はこれまで未知に等しかった、哺乳動物Pcdhの機能解明に重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 と結合し、大脳皮質神経細胞に局在している事を明らかとした。本研究はこれまで未知に等しかった、哺乳動物Pcdhの機能解明に重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 |