本研究はウイルス感染によって誘導されるI型IFNの発現機構において、転写因子IRFがいかなる機能を持つかについて解析を行ったものである。IRF分子には複数のものが知られているが、遺伝子欠損マウスより得られた細胞系を用いることで、下記に示すようなIRF分子の個別の機能を明らかにしている。 1.IRF分子の一つであるp48、あるいはI型IFN受容体を欠損させた細胞を用いた解析により、ともにI型IFNとして知られているIFN-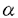 とIFN- とIFN-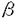 が異なる機構により誘導されることを明らかにした。すなわち、IFN- が異なる機構により誘導されることを明らかにした。すなわち、IFN-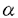 はその発現誘導にIFN受容体からのシグナル経路を必要とするのに対し、IFN- はその発現誘導にIFN受容体からのシグナル経路を必要とするのに対し、IFN-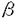 はこれとは異なる経路によって誘導されることを示した。また、p48は細胞がIFNに応答するために必要な分子であると考えられていたが、IFNの産生そのものに重要な機能を持つことが本研究によって初めて明らかにされた。 はこれとは異なる経路によって誘導されることを示した。また、p48は細胞がIFNに応答するために必要な分子であると考えられていたが、IFNの産生そのものに重要な機能を持つことが本研究によって初めて明らかにされた。 2.IFN-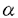 の発現誘導にはIFN受容体からのシグナルが必要であるが、IFN- の発現誘導にはIFN受容体からのシグナルが必要であるが、IFN-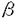 の発現はこのシグナルには依存せずに誘導されることから、IFN- の発現はこのシグナルには依存せずに誘導されることから、IFN-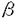 の初期産生がIFN- の初期産生がIFN-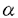 の発現誘導に重要であるというモデルを提唱した。このモデルを検証するため、IFN- の発現誘導に重要であるというモデルを提唱した。このモデルを検証するため、IFN-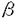 を欠損させたマウスを作製し、そこから得られた繊維芽細胞においてはウイルスによるIFN- を欠損させたマウスを作製し、そこから得られた繊維芽細胞においてはウイルスによるIFN-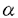 の誘導が著減することを明らかにした。 の誘導が著減することを明らかにした。 3.IFN-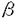 の発現誘導を担う分子としてIRF-3に着目し、これを高発現させた細胞を用いてIRF-3がウイルス感染によってリン酸化を受け、細胞質から核内へ移行することを示した。また、IRF-3が転写のコアクチベーターであるCBP/p300とともにIFN- の発現誘導を担う分子としてIRF-3に着目し、これを高発現させた細胞を用いてIRF-3がウイルス感染によってリン酸化を受け、細胞質から核内へ移行することを示した。また、IRF-3が転写のコアクチベーターであるCBP/p300とともにIFN-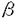 のプロモーター領域に結合することをゲルシフトアッセイによって示した。さらにIRF-3の高発現によってIFN- のプロモーター領域に結合することをゲルシフトアッセイによって示した。さらにIRF-3の高発現によってIFN-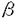 の発現量が増加することを示した。さらに、ES細胞の段階でIRF-3を欠損する細胞の作出にも成功し、IRF-3がウイルス感染によるIFN- の発現量が増加することを示した。さらに、ES細胞の段階でIRF-3を欠損する細胞の作出にも成功し、IRF-3がウイルス感染によるIFN-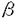 の発現誘導に必要であることを明らかにした。 の発現誘導に必要であることを明らかにした。 4.IRF-3とC末端に高い相補性を持つIRF-7が、IFN受容体からの刺激によってその発現が強く誘導されることを見いだした。またこの誘導がp48に依存することを明らかにした。さらにIRF-7がウイルス感染によって細胞質から核内へ移行すること、核内に移行したIRF-7がリン酸化を受けていることを初めて示した。 5.p48欠損細胞にIRF-7を強制発現させることで、低下していたIFN-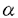 の発現が回復することを示した。このように、IFN受容体からのシグナル経路が最終的にIRF-7の活性化を引き起こし、IFN- の発現が回復することを示した。このように、IFN受容体からのシグナル経路が最終的にIRF-7の活性化を引き起こし、IFN-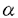 の発現へとつながることを明らかにした。 の発現へとつながることを明らかにした。 以上、本論文においては、IRFファミリー分子の遺伝子欠損細胞を用いた解析により、p48、IRF-3、IRF-7それぞれのIRF分子の持つ個々の機能を明らかにした。本研究によってウイルス感染時におけるI型IFNの発現誘導とその制御の分子機構が明らかとなった。その成果はウイルス感染に対する生体防御機構の解明に重要な貢献をするものと思われる。よって学位の授与に値するものと考えられる。 |