1.背景および研究目的 温熱療法は化学療法や放射線療法と組み合わせることにより、悪性腫瘍の治療法として有用な治療法である。しかしながら体内深部の温度を制御する手法が存在しないがために、現状では体内深部臓器への臨床応用には限界がある。効果的な温熱療法には、周辺組織に障害を与えずに、腫瘍細胞に対しては十分な加熱を行う必要があるが、このためには加熱部位の温度を正確に計測する必要がある。現在、温熱療法中の組織内温度は体内の標的部分に熱電対、サーミスタ、fiber-optic probeといった温度センサーを挿入することによって計測されている。この侵襲的な方法では患者に肉体的にも精神的にも大きな苦痛を与えるばかりか感染や腫瘍の播種を起こす危険性もあり、温熱療法普及のための妨げとなっている。またこの方法では温度センサー挿入部位の温度しか計測することが出来ず、標的部位や周囲の健常組織の温度分布を知ることは困難である。このため非侵襲的で正確かつ広範囲の温度を計測できる手法の確立が望まれてきた。
さらに組織内pH(水素イオン指数)の計測も、より効果的に温熱療法を行うためには必要になってくる。pHは代謝の変化を敏感に反映する重要な生理学的指標であり、治療前後および治療中の患者にとって有用な情報となりうる。pHの変化を見ることにより、正常細胞や腫瘍細胞の温度感受性や加熱特性を調べることができ、温熱療法にとって重要な指標となる。しかしながら温度と同様に非侵襲的にpHを計測する有効な手段は存在しない。
本研究では、臨床応用が可能な磁場中で、NMR(核磁気共鳴法)とランタノイド複合体(thulium 1,4,7,10-tetraazzcyclododecane-1,4,7,10-tetrakis(methylene phosphonate)以下TmDOTP5-)を用いた非侵襲的な生体内温度およびpH計測法を検討し、実際にラットを用いた動物実験でその評価を行うことを目的とした。
2.方法 常磁性物質内における核スピンの化学シフトは、温度およびpH依存性があることが良く知られている。すなわち
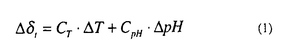
ここでCTは化学シフトの温度依存係数、CpHはpH依存係数である。
TmDOTP5-中には4個ずつ6グループの不等価な電子スピンを持つ1Hが存在している。
この式は単純な2変数の線形方程式であり、2種類の不等価なスピン(i,j)をもつ1Hの化学シフトを用いることにより以下の2式が導出でき、これらを連立させて解くことで、 Tおよび
Tおよび pHを求めることができる。
pHを求めることができる。
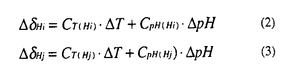
まず本研究では、化学シフトおよび温度さらに化学シフトおよびpHのそれぞれの関係が、温熱療法で使用される範囲中で、直線関係にあるかどうかを確かめた。さらにTmDOTP5-の化学シフトが、TmDOTP5-の濃度や生体中に存在する反磁性イオンであるCa2+のようなイオンの結合によって、影響を受けるかどうかを調べた。
実験には臨床で使用されている磁場の強さと同程度の磁場2TのBruker biospec imaging/spectroscopyシステムを使用した。MR信号は1Hおよび31Pの周波数と共鳴するように調整された直径2.5cmの表面コイルによって得た。1Hの信号は90度パルスによる連続単パルス(Bandwidth10KHz、繰り返し時間30ms、1024回平均、データ収集時間30sec)を用いて計測した。
まずin vitroで以下のような実験をおこない、CTおよびCpHの値を計測した。
CTの計測には、TmDOTP5-生理食塩水溶液、濃度15mMを用いた。湯浴中にサンプルをおき、熱電対により溶液中の温度を計測しながら、23℃から47℃まで温度を変化させた。またTmDOTP5-溶液の濃度による影響を調べるため、濃度を3mMから30mMまで変化させ同様に計測した。さらにCa2+の結合による影響を調べるため、15mMのTmDOTP5-溶液に2.6mM、5.3mMおよび11mMのCaCl2をそれぞれ加え同様に計測を行った。
CpHの計測には生体内pH環境に近い牛血漿に溶解した15mM濃度の溶液を用いた。0.1MNaOHおよび0.1MHClを加えて、pH6.0からpH8.0までpHを変化させ計測を行った。pHの計測にはBeckman model40pHメータを使用した。
in vivoではラット(n=8,体重平均300g)を使用し、大腿部の温度を超音波を用いて体温から45℃まで変化させた際のTmDOTP5-中の1Hの化学シフトを計測し、in vitro実験で算出したCTおよびCpHを使用して(1)式より同部分の温度およびpHの変化を計測した。
全身麻酔下に、大腿部の筋肉へ銅・コンスタンタン熱電対および微小pHセンサーを挿入した。熱電対およびpHセンサーは雑音源となるためMR信号計測中は停止させ、直前直後の値の平均値をそれぞれ温度とpHの真値とした。
in vitro実験で使用したNMRを用いて、ラットを磁界の中央に配置し、MR信号をin vitro実験と同様にして得るようにした。15mM TmDOTP5-生理食塩水溶液を全投与量0.15mmol/kg投与した。
温度を変化させるために、2.07MHz、20Wの超音波を直径2.5cmのトランスデューサから放射し加熱した。MR信号を採取している間、温度変化が0.5℃以下になるように出力を調整しながら、温度を25℃から45℃の範囲で段階的に上昇させた。
このようにして得た1Hおよび31Pの化学シフトから温度およびpHを求め、真値と比較した。
3.結果in vitro実験 (1)TmDOTP5-中の6グループの1Hの化学シフトを計測したところ、それぞれの1Hは固有のCTおよび定数を示した(表1)。またpH一定の場合、温度範囲25℃から45℃の範囲において、TmDOTP5-中の1Hの化学シフトは温度の直線関数であった。
(2)温度一定の場合、TmDOTP5-中の6グループの1Hの化学シフトはpH6.5〜pH8.5の範囲において、pHの直線関数であった。
(3)pHを6.5、7.2、8.5と変化させた場合の1Hの化学シフトと温度との関係を調べた。これよりpHが変化した場合もCT(直線の傾き)は変化せず一定であることが分かった。これはTmDOTP5-中の1HのCTはpHに無関係であることを示す。
(4)TmDOTP5-の濃度はCTおよびCpHに対して影響を与えないことが分かった。
(5)溶液中のCa2+の濃度はCTおよびCpHに対して影響を与えないことが分かった。
in vivo実験 (1)温熱療法の範囲において、in vitroでの実験結果と同様に、化学シフトと温度は直線関係を示した。
(2)8匹のラットについて温度およびpHの変化を計測した化学シフト、[2]および[3]式を用いて計算し、実際の熱電対や微小pHセンサーの値(真値)と比較した(図1)。
(3)温度については相関係数0.981平均誤差0.471℃、標準偏差0.0480℃と良い相関をしめした。、pHについては平均誤差0.0582、標準偏差6.47×10-3となり誤差は小さいが、両者の相関係数は0.68であった。
4.考察 本研究により、TmDOTP5-中の1Hの化学シフトは強い温度およびpH依存性を示すことが分かった。またTmDOTP5-というただ1つのマーカを使用することにより、生体内で温度およびpHの変化をそれぞれ独立に測定できる方法を確立した。また臨床で使用される範囲の磁場で十分な精度が得られる可能性を示した。このことによりこれまで計測に問題があるため、あまり広く強い使用されることのなかった温熱療法が本手法の応用により、より多くの腫瘍に対して使用できる可能性がでてきたと考えられる。
温度については必要十分な精度で計測が可能であったが、pHについては誤差は十分であるがパラつきがみられた。これは(1)pHの変動範囲が小さい、(2)電極で測定した部位(2mm)に比べて、NMRでの計測範囲(2.5cm)が大きい、ことが原因として考えられる。今回の実験では温度上昇時の暴露時間が短かったため、正常細胞には変化がほとんど見られずpHが変化しなかった。またNMRでは2.5cmの範囲の平均値のpHを計測しており、pHセンサーの測定部位(2mm)で計測した値と違うことが考えられる。温度と比べてpHは微小循環や代謝の影響により微小範囲でも大きく違う部分があり、電極計測値とNMR計測値が違う原因になったと考えられ、今後の課題である。
さらにMRIとMRSを組み合わせて、生体内の温度及びpHの分布を計測する方法の開発も必要であると考えている。