心筋細胞において、細胞内カルシウム濃度([Ca2+]i)の上昇が興奮収縮連関の橋渡しをする重要なメカニズムとされている。すなわち、細胞膜の脱分極により膜上のLタイプCaチャンネルが開口し、Ca2+が細胞内に流入する。流入したCa2+は筋小胞体膜上のリアノジンリセプター(筋小胞体Caチャンネル)に結合し筋小胞体からCa2+を放出する。この機構は、Ca2+依存性Ca2+放出(Ca2+-induced Ca2+release,CICR)と呼ばれ、細胞収縮に必要なCa2+量のほとんどがこれに依存するとされている。細胞内外から供給されたCa2+は、筋小胞体Caポンプ(SR CaATPase)により筋小胞体内に再度取り込まれるとともに、細胞膜上にあるNa/Ca交換体(Na/Ca exchanger)により細胞外に排出される。その他にも細胞質よりCa2+を取り除く機構(細胞膜上のCaポンプやミトコンドリアなど)が存在するが、その速度の遅さから通常の収縮している心筋においては殆ど機能しないと考えられている。したがって、収縮している心筋において安定した状態(平衡状態)では、Na/Ca交換体は流入したCa2+量と同量のCa2+を排出していることになる。1分子のCa2+は3分子のNa+と交換して運ばれるが、Ca2+を細胞外にくみ出す場合を"順行性"(forward function)、Ca2+を取り込む場合を"逆行性"(reverse function)と呼んでいる。Na/Ca交換体の"順行性"機能は、細胞内Ca2+の排出に重要と一般に受け入れられているが、"逆行性"機能の意義についてはいまだ明快な回答は得られていない。すなわち、Na/Ca交換体は、生理的な心筋収縮過程においてCa2+を取り込むことがあるのかどうか、またもしそうならその流入したCa2+はCICRに関与するのかどうかは今だ不明である。 近年、Philipsonらのグループは、分子生物学的手法を用い、心筋細胞特異的にNa/Ca交換体を過剰発現したマウスモデル(TG)を作成することに成功し、当初の研究で、2.5倍"順行性"機能が上昇していることを示した。今回私は、このマウスから心室筋細胞を単離し細胞内Ca2+濃度の動態を、野生型(WT)と比較検討した。また、過剰発現したNa/Ca交換体が、活動電位、細胞内Na+濃度、LタイプCaチャンネル、筋小胞体内Ca貯蔵量、SR CaATPaseにどのような影響を与えるかを調べた。更に、これらの結果よりNa/Ca交換体の"逆行性"機能の生理学的意義に関して考察した。 Ca蛍光色素fluo-3を負荷した心室筋細胞を電気刺激(ペーシング)により4秒間隔で収縮させ、平衡状態に達した後、[Ca2+]iトランジェントを記録定量した。収縮期ピーク・拡張終期[Ca2+]iには有意な変化を認めなかった。しかしながら、トランジエントの時間経過において、収縮期ピークまでの時間はTG群で有意に延長していた。また、TG群で[Ca2+]iの減少曲線の時定数(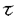 )は有意に短く、"順行性"機能の亢進が示唆された。"順行性"機能の亢進を確認するために、平衡状態の心筋細胞の外液をRapid solution switcherを用い瞬時(0.004秒以内)に10mmol/Lカフェイン溶液に置換しそのまま4秒間還流し,またもとの外液に戻した。カフェインは、筋小胞体内のCa2+を放出させるとともにSR CaATPaseをブロックする。したがって、カフェイン処理により上昇した[Ca2+]iは、Na/Ca交換体依存性に低下する。TG群においてその低下速度は有意に亢進していた。また、Ni2+でNa/Ca交換体をブロックして同様の処理を行った場合、[Ca2+]i低下速度は両群で著明に延長したが、その速度自体は、両群間で差を認めなかった。これらの結果から、TG群において、Na/Ca交換体の"順行性"機能が亢進していることとともに、それ以外のCa2+排出機構には差がないことが解った。Na/Ca交換体の機能は、細胞内外Na+濃度差に敏感に影響を受ける事が解っているが、2種類のNa蛍光色素Sodium GreenとSBFIを用いて測定した[Na+]iは両群間で差がなかった。このことから、"順行性"機能亢進は、細胞内イオン環境の変化ではなく、Na/Ca交換体の強制発現によるためと考えられた。先に示したように、ペーシングにより誘発された[Ca2+]iトランジエントの[Ca2+]i低下速度がTG群で亢進していたが、これが純粋にNa/Ca交換体の機能亢進によるためであることを示すためにには、SR CaATPase機能が付随的に亢進していないことを示す必要がある。そこで私は、独自の方法を用いSR CaATPaseの機能を調べた。Rapid solution switcherを用い、静止状態の心筋細胞を0-Na+,0-Ca2+溶液内にトラップした後、0.1秒間だけ10mmol/Lのカフェインで処理した。この操作により、筋小胞体内のCa2+が細胞質内へ放出され、つづいてカフェイン効果の消失とともにSR CaATPaseにより取り込まれる。このとき、Na/Ca交換体は0-Na+,0-Ca2+溶液のためいずれの向きにも機能できない。この操作により観察された[Ca2+]iトランジエントの最大値ならびに減衰曲線は、両群間で差を認めず、SR CaATPaseの機能がTG群で変化していないことが示された。以上より、強制発現したNa/Ca交換体は実際に機能し、収縮している心室筋の[Ca2+]iの低下を促進することが示された。 )は有意に短く、"順行性"機能の亢進が示唆された。"順行性"機能の亢進を確認するために、平衡状態の心筋細胞の外液をRapid solution switcherを用い瞬時(0.004秒以内)に10mmol/Lカフェイン溶液に置換しそのまま4秒間還流し,またもとの外液に戻した。カフェインは、筋小胞体内のCa2+を放出させるとともにSR CaATPaseをブロックする。したがって、カフェイン処理により上昇した[Ca2+]iは、Na/Ca交換体依存性に低下する。TG群においてその低下速度は有意に亢進していた。また、Ni2+でNa/Ca交換体をブロックして同様の処理を行った場合、[Ca2+]i低下速度は両群で著明に延長したが、その速度自体は、両群間で差を認めなかった。これらの結果から、TG群において、Na/Ca交換体の"順行性"機能が亢進していることとともに、それ以外のCa2+排出機構には差がないことが解った。Na/Ca交換体の機能は、細胞内外Na+濃度差に敏感に影響を受ける事が解っているが、2種類のNa蛍光色素Sodium GreenとSBFIを用いて測定した[Na+]iは両群間で差がなかった。このことから、"順行性"機能亢進は、細胞内イオン環境の変化ではなく、Na/Ca交換体の強制発現によるためと考えられた。先に示したように、ペーシングにより誘発された[Ca2+]iトランジエントの[Ca2+]i低下速度がTG群で亢進していたが、これが純粋にNa/Ca交換体の機能亢進によるためであることを示すためにには、SR CaATPase機能が付随的に亢進していないことを示す必要がある。そこで私は、独自の方法を用いSR CaATPaseの機能を調べた。Rapid solution switcherを用い、静止状態の心筋細胞を0-Na+,0-Ca2+溶液内にトラップした後、0.1秒間だけ10mmol/Lのカフェインで処理した。この操作により、筋小胞体内のCa2+が細胞質内へ放出され、つづいてカフェイン効果の消失とともにSR CaATPaseにより取り込まれる。このとき、Na/Ca交換体は0-Na+,0-Ca2+溶液のためいずれの向きにも機能できない。この操作により観察された[Ca2+]iトランジエントの最大値ならびに減衰曲線は、両群間で差を認めず、SR CaATPaseの機能がTG群で変化していないことが示された。以上より、強制発現したNa/Ca交換体は実際に機能し、収縮している心室筋の[Ca2+]iの低下を促進することが示された。 平衡状態に達した心筋細胞において、細胞外からのCa2+流入量と細胞外への排出量は平衡状態にあるはずである。Ca2+排出機能の亢進しているTG群では、それゆえにCa2+の流入が亢進している可能性が考えられる。そこで、細胞膜上のLタイプCaチャンネルの機能をvoltage-clamp法を用いて調べた。測定されたCa2+電流(ICa)密度は、-40から60mVにおいて変化していなかった。すなわち、TG群においてCa2+排出機構のみが亢進していることになり、平衡状態の[Ca2+]iトランジェントの収縮期最大値および筋小胞体内Ca貯蔵量はWT群に比し低下していなければならないと思われる。しかしながら、実際に測定された収縮期最大値はむしろ軽度上昇していた。また、筋小胞体内のCa貯蔵量の指標となるカフェイン依存性の[Ca2+]iトランジエントの振幅は、両群間で差がなかった。さらに正確に比較するために、voltage-clamp法を用い平衡状態にある心室筋細胞の筋小胞体内Ca量を測定した。心筋細胞を-80mVにvoltage-clampし、4秒ごとに0.2秒間0mVに脱分極することで筋小胞体内のCa濃度を平衡状態に導いた後、Rapid solution switcherを用いてカフェインで6秒間還流した。カフェインで放出されたCa2+は、Na/Ca交換体を介して細胞外へ排出されるが、このとき1Ca2+当たり3Na+が取り込まれるので全体として内向きの電流が記録される。この電流の時間積分値(∫lNa/Ca)が筋小胞体から放出されたCa2+量の1つの指標すなわち筋小胞体内のCa貯蔵量の指標となる。測定された∫lNa/Caは、lCa同様両群間で差がなかった。以上の結果から、細胞内Ca2+排出機構の亢進しているTG群においては、Na/Ca交換体によるCa2+の流入も同様に亢進することによりその平衡状態が保たれている可能性が考えられた。そこで、私は、ペーシングにより平衡状態に達した心室筋細胞をLタイプCaチャンネルの阻害薬であるnifedipide(10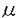 mol/L)で5分間還流した。WT群において1分以内に急速に[Ca2+]iトランジェントの振幅がほとんどなくなったのに対し、TG群において[Ca2+]iトランジェントの振幅は有意に大きく保たれしかもryanodine(1 mol/L)で5分間還流した。WT群において1分以内に急速に[Ca2+]iトランジェントの振幅がほとんどなくなったのに対し、TG群において[Ca2+]iトランジェントの振幅は有意に大きく保たれしかもryanodine(1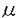 mol/L),thapsigargin(0.5 mol/L),thapsigargin(0.5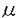 mol/L)を同時に加えた場合この効果は消失した。すなわち、nifedipineに反応しない[Ca2+]i上昇機構がTG群で亢進しておりしかもこの機構は、CICRを促進していると考えられる。しかしながら、この実験系に対する1つの批判は、Na/Ca交換体が細胞内にCa2+を取り込んでいることは示唆されるも、CICRの亢進に直接関与しているとは結論できないことである。つまり、nifedipine還流後の筋小胞体内Ca量減少の時間経過を引き伸ばしているだけかもしれないという仮設を否定できないということである。そこで私は、筋小胞体内のCa量を変えることなくnifedipineにてLタイプCaチャンネルをブロックすることでカルシウムトランジェントの振幅がどう変化するのか検討した。10秒間隔で細胞をペーシングし平衡状態に達した後、Rapid solution switcherを用いテスト刺激の9秒前からnifedipine(20 mol/L)を同時に加えた場合この効果は消失した。すなわち、nifedipineに反応しない[Ca2+]i上昇機構がTG群で亢進しておりしかもこの機構は、CICRを促進していると考えられる。しかしながら、この実験系に対する1つの批判は、Na/Ca交換体が細胞内にCa2+を取り込んでいることは示唆されるも、CICRの亢進に直接関与しているとは結論できないことである。つまり、nifedipine還流後の筋小胞体内Ca量減少の時間経過を引き伸ばしているだけかもしれないという仮設を否定できないということである。そこで私は、筋小胞体内のCa量を変えることなくnifedipineにてLタイプCaチャンネルをブロックすることでカルシウムトランジェントの振幅がどう変化するのか検討した。10秒間隔で細胞をペーシングし平衡状態に達した後、Rapid solution switcherを用いテスト刺激の9秒前からnifedipine(20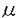 mol/L)で細胞を還流し、テスト刺激で誘発された[Ca2+]iトランジェントをその直前(nifedipine処理前)のトランジェントと比較した。WT群では、[Ca2+]iトランジェントがほとんど消失したのに対し、TG群では著明に大きい[Ca2+]iトランジェントが依然観察された。しかも、同様の操作をNi2+(5mmol/L)を用いて行ったところ両群で[Ca2+]iトランジェントは完全に消失した。すなわち、TG群において、nifedipineに反応しないかつNi2+に反応するCa2+流入がCICRを亢進させたと考えられる。すなわち、心室筋細胞においてそのようなCa2+流入機構は、Na/Ca交換体しかなく、それゆえに、Na/Ca交換体は、Ca2+の流入さらにはCICRに関与すると考えられる。 mol/L)で細胞を還流し、テスト刺激で誘発された[Ca2+]iトランジェントをその直前(nifedipine処理前)のトランジェントと比較した。WT群では、[Ca2+]iトランジェントがほとんど消失したのに対し、TG群では著明に大きい[Ca2+]iトランジェントが依然観察された。しかも、同様の操作をNi2+(5mmol/L)を用いて行ったところ両群で[Ca2+]iトランジェントは完全に消失した。すなわち、TG群において、nifedipineに反応しないかつNi2+に反応するCa2+流入がCICRを亢進させたと考えられる。すなわち、心室筋細胞においてそのようなCa2+流入機構は、Na/Ca交換体しかなく、それゆえに、Na/Ca交換体は、Ca2+の流入さらにはCICRに関与すると考えられる。 以上の研究結果より、Na/Ca交換体は細胞外よりCa2+を取り込みCICRに関与するとともに、流入したCa2+と同量のCa2+を細胞外へ排出すると考えられる。そのNa+とCa2+の交換比は3:1であり、Ca2+を取り込むときは、外向き電流を生じ再分極に、またCa2+を排出するときは内向き電流を生じ脱分極に寄与すると考えられる。そこで、私はTG群において活動電位がどのように変化しているのかを調べた。current-clamp法を用い平衡状態の心筋細胞から活動電位を記録した。TG群において、活動電位の最大値つまり0相のピーク値が有意に低下していた。さらに第1相再分極速度が有意に亢進していた(50%再分極時間が短縮していた)。また一方、90%再分極時間は延長していた。活動電位と[Ca2+]iトランジェント同時記録により、活動電位第0-1相は、カルシウム上昇期に相当し、2相後半以降カルシウム減少期に当たることから、これらの結果はNa/Ca交換体による[Ca2+]i流入排出の亢進と矛盾しない。しかしながら、50%再分極時間に重要な役割をはたす一過性外向きK+電流(Ito)や、2-3相の再分極に重要な外向きK+電流に関しては本研究では明らかではなく、今後の詳細な検討が必要である。 本研究において、Na/Ca交換体は、定常状態に達した収縮している心筋細胞においてCa2+排出のみならずCa2+流入さらにはCICRにも関与すると考えられる。またNa/Ca交換体の発現の亢進は、"順行性""逆行性"の両方の機能亢進という形で[Ca2+]iの平衡状態を保つとともに、活動電位の形を早期再分極速度の亢進と後期再分極の延長という形で変化させる可能性が示唆された。しかしながら、Na/Ca交換体が定量的にどれだけのCa2+を生理的条件下で流入排出するかに関しては今後のより詳細な検討が必要である。 |