AML1遺伝子は(8;21)転座型白血病の切断点の解析から21番染色体に位置することが同定され、その遺伝子産物は種々の白血病において、AML1/MTG8(ETO)などの融合蛋白質を形成し、白血病発症と深く関与することが知られている。さらに、AML1は造血細胞の分化・増殖に深く関与することが知られている。既に、我々はAML1がそのアイソフォームのAML1a及びAML1bにより骨髄球系細胞の分化及び転写活性化能を相反的に制御することを示した。AML1はミエロペルオキシダーゼ、好中球エラスターゼ、マクロファージ・コロニー刺激因子受容体などの種々の造血に関与する遺伝子の転写を制御することが知られている。また、AML1の遺伝子欠失マウスは胎生致死で肝造血がみられないことが知られている。AML1にはアイソフォームとしてAML1a,AML1b,AML1cの3つが知られているが、そのうちAML1bが転写活性化型として知られ、当論文上ではAML1bをAML1として表記する。 Drosophilaの体節形成遺伝子であるRuntはAML1,マウスPEBP2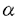 B/CBF B/CBF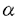 2とともにRuntファミリー蛋白質を形成する。これらの蛋白質にはDNA結合能を有するRuntドメインが保存されているが、その他にカルボキシル末端には5アミノ酸からなるVWRPYモチーフが完全に保存されている。Drosophilaの神経形成に関与するHairy関連蛋白質のカルボキシル末端にもVWRPYモチーフと類似したWRPWモチーフが保存されている。Hairy関連蛋白質がその標的遺伝子の転写を抑制するさいにGrouchoとWRPWモチーフを介して結合し、Grouchoが協働因子として機能することが知られている。Grouchoのヒト相同性蛋白質であるTLE1も哺乳類のHairy関連蛋白質の一つであるHES-1と結合することが知られている。当論文で、私はAML1とTLE1がin vitro及びin vivoの実験系で結合し、TLE1はAML1のカルボキシル末端を介してその転写活性化能を抑制することを見いだした。これらの結果により、TLE1はAML1の抑制因子として機能することが示され、当論文は造血および白血病発症におけるAML1の機能の抑制機構の解明について重要な洞察を与えると考えられる。 2とともにRuntファミリー蛋白質を形成する。これらの蛋白質にはDNA結合能を有するRuntドメインが保存されているが、その他にカルボキシル末端には5アミノ酸からなるVWRPYモチーフが完全に保存されている。Drosophilaの神経形成に関与するHairy関連蛋白質のカルボキシル末端にもVWRPYモチーフと類似したWRPWモチーフが保存されている。Hairy関連蛋白質がその標的遺伝子の転写を抑制するさいにGrouchoとWRPWモチーフを介して結合し、Grouchoが協働因子として機能することが知られている。Grouchoのヒト相同性蛋白質であるTLE1も哺乳類のHairy関連蛋白質の一つであるHES-1と結合することが知られている。当論文で、私はAML1とTLE1がin vitro及びin vivoの実験系で結合し、TLE1はAML1のカルボキシル末端を介してその転写活性化能を抑制することを見いだした。これらの結果により、TLE1はAML1の抑制因子として機能することが示され、当論文は造血および白血病発症におけるAML1の機能の抑制機構の解明について重要な洞察を与えると考えられる。 私はまず、AML1とTLEとの物理的結合を検討した。TLEは4つのサブタイプからなるがTLE1が最も発現が普遍的にみられることからAML1とTLE1の結合について検討した。COS-7細胞株で発現させたTLE1のGST融合蛋白質により、同じくCOS-7細胞株で発現させたAML1の共沈を試みた結果、TLE1のGST融合蛋白質によりAML1が共沈された。以上よりAML1とTLE1のin vitroでの特異的な結合が示された。 TLE1はQ,GP,CcN,SP,WD-40の5つのドメインからなるが、どのドメインを介してAML1と結合するかを次に検討した。COS-7細胞株にTLE1の各ドメインのGST融合蛋白質とAML1を導入し共沈を試みた。その結果TLE1のSPドメインのGST融合蛋白質によってAML1が共沈された。さらに、WD-40ドメインとも非常に弱いながら結合が示された。以上からin vivoでTLE1は主にSPドメインを介してAML1と結合することが示された。 Runtファミリー蛋白質にはそのアミノ酸末端側にDNA結合能を有するRuntドメイン、カルボキシル末端にはVWRPYモチーフが保存され、その間には転写活性化能を有するPST領域が保存されている。私はAML1のこれらの領域の各種欠失変異体を作製し、TLE1のSPドメインのGST融合蛋白質とのin vivoでの結合様式を検討した。その結果AML1の全長、カルボキシル末端の欠失変異体、Runtドメインの欠失変異体、PST領域の一部の欠失変異体はいずれもTLE1のSPドメインとの共沈が示されたが、Runtドメインとカルボキシル末端の両方の欠失変異体は共沈されなかった。以上から、TLE1はAML1のRuntドメインおよびカルボキシル末端を介してAML1と結合することが示された。私はTLE1のSPドメインのさらに詳細な欠失変異体のGST融合蛋白質を作製しAML1のRuntドメイン、カルボキシル末端の欠失変異体とのin vivoでの結合様式を検討した。その結果、SPドメインの第269-343アミノ酸の領域のGST融合蛋白質はAML1のRuntドメイン,カルボキシル末端のいずれの欠失変異体とも共沈されなかった。SPドメインの第269-399アミノ酸の領域のGST融合蛋白質はAML1のカルボキシル末端の欠失変異体とは共沈されなかったが、Runtドメインの欠失変異体との共沈が示された。さらにSPドメインの全長のGST融合蛋白質はRuntドメイン、カルボキシル末端のいずれの欠失変異体とも共沈が示された。以上より、TLE1はSPドメインの第344-399アミノ酸の領域を介してAML1のカルボキシル末端と、SPドメインの第400アミノ酸からWD-40ドメインにかけての領域を介してAML1のRuntドメインと結合することが示された。AML1は種々の造血に関与する遺伝子の転写活性を誘導することが知られている。そこで、AML1の転写活性化能の誘導に対するTLE1の作用について検討した。HeLa細胞株にマクロファージ・コロニー刺激因子受容体のプロモーター領域を有するルシフェラーゼの応答プラスミドとAML1,PEBP2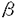 /CBF /CBF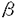 の発現プラスミドを導入するとマクロファージ・コロニー刺激因子受容体の転写活性は約7倍に上昇したが、これにTLE1を発現させるとその転写活性は約三分の一に低下した。AML1のカルボキシル末端の欠失変異体とPEBP2 の発現プラスミドを導入するとマクロファージ・コロニー刺激因子受容体の転写活性は約7倍に上昇したが、これにTLE1を発現させるとその転写活性は約三分の一に低下した。AML1のカルボキシル末端の欠失変異体とPEBP2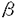 /CBF /CBF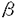 の発現プラスミドを導入してもマクロファージ・コロニー刺激因子受容体の転写活性は約7倍に上昇したが、これにTLE1を発現させてもその転写活性化能は抑制されなかった。好中球エラスターゼのプロモーターを用いて、同様の実験をおこなったが同様の結果を得た。以上より、TLE1はAML1のカルボキシル末端を介してその転写活性化能を抑制することが示された。 の発現プラスミドを導入してもマクロファージ・コロニー刺激因子受容体の転写活性は約7倍に上昇したが、これにTLE1を発現させてもその転写活性化能は抑制されなかった。好中球エラスターゼのプロモーターを用いて、同様の実験をおこなったが同様の結果を得た。以上より、TLE1はAML1のカルボキシル末端を介してその転写活性化能を抑制することが示された。 私は本論文においてAML1とTLE1のin vitro,in vivoでの結合および、相互作用を示したが、この結合はTLE1の主にSPドメインを介して行われることを示した。これは、DrosophilaにおいてGrouchoとHairy関連蛋白質の相互作用はSPドメインを介して行われていることと合致する。さらに、TLE1のWD-40ドメインを介しての結合も示したが、酵母において普遍的抑制因子として機能することが知られているTup1pにおいてもWD-40ドメインを介した蛋白質の相互作用がみられることが知られている。TLE1のSPドメインの詳細な欠失変異体とAML1のRuntドメイン,カルボキシル末端の欠失変異体との結合様式の解析よりAML1のカルボキシル末端はSPドメインの中間部分と、AML1のRuntドメインはSPドメインのカルボキシル末端側からWD-40ドメインにかけての領域と結合することが示された。さらに、TLE1はAML1の転写活性化能の抑制因子として機能することが示された。この抑制機能のメカニズムは(1)Groucho/TLEがヒストンH3と結合することにより、転写の活性化能を抑える(2)AML1と協調して転写活性化能を誘導すると考えられるEts-1,Myb,C/EBPなどとAML1との結合を妨げて転写活性化能を抑制するなどが考えられる。 |