造血器腫瘍を含む癌においては、遺伝子変異の蓄積がみられることが知られている。遺伝子変異には、点突然変異、数塩基程度の欠失・挿入などの比較的小さな変異から、染色体転座、染色体間の組み換えなどの大きな変異まで様々なものがあるが、近年、その背景に、DNA複製、修復機構の異常が関与している可能性が示され、注目されている。 家族性大腸癌の一つである遺伝性非腺腫性大腸癌(hereditary non-polyposis colorectal cancer,HNPCC)は常染色体優性遺伝をする疾患で、大腸癌を主として、子宮体癌、胃癌、白血病、リンパ腫などを発生しやすい。近年、HNPCCの大部分において、DNAの修復に関与する「ミスマッチ修復遺伝子」群に属するhMLH1,hMSH2,hMSH6,hPMS1,hPMS2のいずれかの変異が生殖細胞に見られることが明らかになった。一方、HNPCCの患者の90%以上において、マイクロサテライトの不安定性(ヒトゲノムに存在する1〜数塩基の短い配列を単位とする繰り返し配列における繰り返し回数の変異)が見られることも分かった。このことは、ミスマッチ修復系に異常があると、遺伝子変異の起こりやすい状態(=遺伝的不安定性)が起こり、その結果として、癌遺伝子や癌抑制遺伝子の異常が蓄積して発癌にいたる可能性を強く示唆している。 DNA複製、修復機構は、大腸菌からヒトに至るまで、種を超えて保存されている。DNAの複製過程では、誤った塩基が新生鎖に取り込まれた場合、DNAポリメラーゼ(ヒトの場合、pol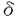 )がこれを認識し除去する(これを「校正機能」(=proofreading)という)。この「校正機能」で校正されないまま新生鎖の伸長が進んでしまった場合に、誤った塩基を修復するのがミスマッチ修復系である。ヒトのミスマッチ修復遺伝子としては、hMLH1、hMSH2〜6、hPMS1〜8が報告されている。現在考えられているミスマッチ修復機構は以下のとおりである。まず、hMSH2蛋白がhMSH6またはhMSH3と結合してヘテロダイマーを形成する。hMSH2と6のヘテロダイマーは、相補的対合ではないミスマッチ部分や1〜2塩基の欠失または挿入によりできる小さなループに結合する。一方、hMSH2とhMSH3のヘテロダイマーは、2塩基以上の欠失または挿入によりできる、より大きなループに結合する。その後、hMLHとhPMS2が結合して複合体を形成し正しい塩基への修復を行う。 )がこれを認識し除去する(これを「校正機能」(=proofreading)という)。この「校正機能」で校正されないまま新生鎖の伸長が進んでしまった場合に、誤った塩基を修復するのがミスマッチ修復系である。ヒトのミスマッチ修復遺伝子としては、hMLH1、hMSH2〜6、hPMS1〜8が報告されている。現在考えられているミスマッチ修復機構は以下のとおりである。まず、hMSH2蛋白がhMSH6またはhMSH3と結合してヘテロダイマーを形成する。hMSH2と6のヘテロダイマーは、相補的対合ではないミスマッチ部分や1〜2塩基の欠失または挿入によりできる小さなループに結合する。一方、hMSH2とhMSH3のヘテロダイマーは、2塩基以上の欠失または挿入によりできる、より大きなループに結合する。その後、hMLHとhPMS2が結合して複合体を形成し正しい塩基への修復を行う。 近年、HNPCC以外にも、散発性の大腸癌をはじめとする様々な腫瘍においてhMLH1,hMSH2をはじめとする修復遺伝子の異常やマイクロサテライトの不安定性が認められることが分かってきた。hMSH3,hMSH6については、遺伝的不安定性を示す大腸癌の30%以上において、それぞれ(A)8trackと(C)8trackにframeshift mutationを認めることが近年報告された。また、大腸癌由来の細胞株におけるpol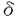 の異常も報告された。これらのことから、発癌における遺伝的不安定性の背景に、様々な修復遺伝子の異常が関与し得ることが示唆される。 の異常も報告された。これらのことから、発癌における遺伝的不安定性の背景に、様々な修復遺伝子の異常が関与し得ることが示唆される。 造血器腫瘍においては、慢性骨髄性白血病(CML)の急性転化、骨髄異形成症候群(MDS)、慢性リンパ性白血病(CLL)、バーキットリンパ腫、HIV関連のリンパ腫においてマイクロサテライトの不安定性を認めたとの報告があり、DNA複製、修復機構の異常の関与の可能性が示唆されてきたが、まだ詳細は検討されていなかった。そこで、私は、今回、造血器腫瘍におけるDNA複製、修復機構の異常の関与を調べるため、造血器腫瘍の細胞株や患者検体を用い、hMLH1,hMSH2,hMSH3,hMSH6,pol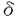 の5つの遺伝子について変異解析を行った。 の5つの遺伝子について変異解析を行った。 まず、ヒト造血器腫瘍細胞株計44個(内訳:骨髄・単球系10株、赤芽球系4株、巨核球系4株、B-リンパ球系18株、T-リンパ球系8株)について、hMLH1,hMSH2,hMSH3,hMSH6,pol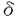 遺伝子の変異解析を行った。各細胞株のgenome DNA、または、RNAの逆転写により合成したcDNAを鋳型として、各遺伝子における、種を超えて保存されている領域や、他の腫瘍において高頻度に変異が報告されている領域をPCRによって増幅した。PCR産物をSSCP法により電気泳動し、泳動度の変化が検出されたものについては、DNA塩基配列を決定した。 遺伝子の変異解析を行った。各細胞株のgenome DNA、または、RNAの逆転写により合成したcDNAを鋳型として、各遺伝子における、種を超えて保存されている領域や、他の腫瘍において高頻度に変異が報告されている領域をPCRによって増幅した。PCR産物をSSCP法により電気泳動し、泳動度の変化が検出されたものについては、DNA塩基配列を決定した。 hMLH1における解析では、exon9を含む領域について行ったPCR-SSCPにおいて、リンパ系腫瘍由来のKCL22,CEM,P30OHKの3細胞株で泳動度の変化を認めた。塩基配列を決定したところ、KCL22では、コドン259においてLeuからSerへのアミノ酸置換を伴うミスセンス変異を、また、CEMとP30OHKでは、intron9の5’端においてAACCgtaa→AACCataaの1塩基置換を認めた。P30OHKでは、正常アレルを検出できず、hemizygousもしくはhomozygousな変異であると考えられた。一方、KCL22,CEMでは正常アレルも検出され、heterozygousな変異と考えられた。さらに、これらの3細胞株における転写レベルと蛋白レベルでのhMLH1の発現の有無を調べた。Northern Blot解析では、CEMでhMLH1のmRNAの発現を認めたが、KCL22とP30OHKにおいてはmRNAが検出されなかった。Western Blot解析では、KCL22,CEM,P30OHKのいずれでも、hMLH1蛋白の発現を検出できなかった。 hMSH6の(C)8trackを含む領域のPCR-SSCPでは、Jurkat,KCL22,Josk-I,SKW3,U937の5細胞株で泳動度の変化を認めた。PCR産物をクローン化し、塩基配列を決定したところ、Jurkatでは塩基配列解析を行った全てのクローンで(C)8→(C)7に、KCL22では塩基配列解析を行った11クローン中6クローンが(C)8→(C)7に、5クローンが(C)8→(C)9に変化し、frameshift mutationを起こしていた。Jurkat,KCL22とも、正常アレルは検出されなかった。Jurkat,KCL22は、いずれもリンパ系腫瘍由来の細胞株である。他の3細胞株(Josk-I,SKW3,U937)の塩基配列解析ではアミノ酸置換を伴わないheterozygousな変異を認めたのみであった。 hMSH3については、Arg→Glnのアミノ酸置換を伴う1塩基置換を4細胞株にて認めたが、heterozygousな変異であり、polymorphismと考えられた。(A)8trackには異常は検出されなかった。 hMSH2については、全ての細胞株において異常は検出されなかった。 pol については、アミノ酸置換を伴わない1塩基置換を数細胞株にて認めたのみであった。 については、アミノ酸置換を伴わない1塩基置換を数細胞株にて認めたのみであった。 hMLH1あるいはhMSH6の変異が検出された細胞株について、マイクロサテライトの異常についても検討を行った。4つのmicrosatellite領域(D18S58,D2S123,BAT25,BAT26)をPCRを用いて増幅し、PCR産物の泳動パターンに異常を認めた場合に「マイクロサテライトの不安定性」(=replication error,RER)があると判定した。hMLH1、hMSH6の変異が検出された細胞株では、いずれも「マイクロサテライトの不安定性」が見られた。 次に、造血器腫瘍の症例、計216例についても、細胞株の場合と同様の方法でhMLH1、hMSH2、hMSH3,hMSH6遺伝子の変異の有無のスクリーニングを行った。216例の内訳は、急性骨髄性白血病(AML)41例、急性リンパ性白血病(ALL)48例,CMLの急性転化35例、非ホジキンリンパ腫(NHL)48例、MDS44例であった。2例のMDS患者骨髄細胞において、hMSH2遺伝子のexon7のcodon390にてLeu→Pheの一アミノ酸置換を伴う点突然変異が観察された。その他の遺伝子では、変異を認めなかった。 以上の結果より、ミスマッチ修復遺伝子hMLH1およびhMSH6の異常がリンパ系白血病細胞株において、一定の頻度で見い出されることが明らかになり、これらのミスマッチ修復遺伝子の不活化がリンパ系腫瘍の発症、進展に重要な役割を果たす例が存在する可能性が示唆された。近年hMLH1およびhMSH6を含むミスマッチ修復遺伝子のノックアウトマウスにおいてリンパ腫が高率に発症すると報告されたことからも、この結果は興味深い。また、hMLH1やhMSH6の変異を認めたリンパ系白血病細胞株ではマイクロサテライトの不安定性が認められたことから、ミスマッチ修復系の異常により、遺伝子変異の起こりやすい状態(=遺伝的不安定性)が起こり、その結果、癌遺伝子や癌抑制遺伝子の異常が蓄積して発癌にいたる、というメカニズムが、HNPCCや散発性の大腸癌などの固型腫瘍のみならず、造血器腫瘍の発症、進展にも寄与する可能性が示唆された。他方、2例のMDSの症例においてhMSH2遺伝子のミスセンス変異を認め、MDSにおいてもミスマッチ修復異常がその発症や進展に関与する症例が存在する可能性が示唆された。しかしながら、これまで検索した限りでは、患者由来のリンパ系白血病細胞においてはhMLH1,hMSH6を含むミスマッチ修復遺伝子の異常は見い出されていない。今後、より多くの症例の蓄積とDNAの正確な複製と修復に関与しうる他の候補遺伝子についても幅広く検討を行うことが望まれる。 |