本研究は、c-fos遺伝子のプロモーター領域に、従来存在しないというのが定説になっていた、heat shock element(HSE)が確かに存在し、様々なストレスがこのDNA elementを介してc-fos遺伝子の転写を亢進させていることを明らかにするために、ノザンブロット・ゲルシフトアッセイ・レポータージーンアッセイを行ったものであり、下記の結果を得ている。 1. 従来の他の細胞を用いた報告同様、ヒト乳癌細胞株MCF-7においても、HSEを介した転写を促進するストレスとして知られている、熱ショック(43℃,1時間の後37℃で培養)・50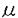 M亜砒酸・100 M亜砒酸・100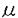 Mカドミウムによって、c-fos mRNA発現が亢進することが確認された。この際、細胞を収穫する8時間前に予め43℃,1時間の熱ショックを加えておくと、上記の刺激によるc-fos mRNA発現亢進が抑制される傾向が観察された。HSP70ないしHSP90が細胞内に多く存在している状態ではHSEを介した転写が起こりにくいと言われている。したがって、この結果は、最初の熱ショックによって蓄積したHSP70ないしHSP90が次のストレスによるHSEを介したc-fosの転写亢進に対して、抑制的に働いたと考えれば説明がつき、c-fos遺伝子の上流にHSEがあるかもしれないという仮説に矛盾しない結果であった。 Mカドミウムによって、c-fos mRNA発現が亢進することが確認された。この際、細胞を収穫する8時間前に予め43℃,1時間の熱ショックを加えておくと、上記の刺激によるc-fos mRNA発現亢進が抑制される傾向が観察された。HSP70ないしHSP90が細胞内に多く存在している状態ではHSEを介した転写が起こりにくいと言われている。したがって、この結果は、最初の熱ショックによって蓄積したHSP70ないしHSP90が次のストレスによるHSEを介したc-fosの転写亢進に対して、抑制的に働いたと考えれば説明がつき、c-fos遺伝子の上流にHSEがあるかもしれないという仮説に矛盾しない結果であった。 2. ヒト・ラット・マウスのc-fos遺伝子上流を調べたところ、転写開始点より-450塩基付近に、HSEに特徴的と言われるGAA/TTCのブロック(GAAnnTTCnnNNNnnTTCnnNNNnnTTC)を見いだした。ヒト・ラット・マウスでGAA/TTCのブロックは完全に保たれており、ラット・マウスではGAA/TTC以外の塩基も全て一致していた。ヒトの同部位の配列をhHSEfos、ラット・マウスの配列をmHSEfosと名付けて、ゲルシフトアッセイを行ったところ、両者とも熱ショック(43℃,30分)を与えた種々の細胞の核蛋白と、HSEに特異的なコンプレックスを形成することが確認された。さらに、HSEと結合する転写因子であるHSF-1に対する抗体を用いたスーパーシフトアッセイにより、確かに両者にはHSF-1が結合することが確かめられた。これらの結果は、hHSEfosおよびmHSEfosがHSEとして働いている可能性を示唆した。 3.最終的に、hHSEfosおよびmHSEfosの機能を確認するためにレポータージーンアッセイを行った。レポータージーンとしては、ホタルルシフェラーゼ遺伝子上流にヒトのc-fosプロモーターをつないだもの(HF456、HF443、mHF456)ないしはSV40プロモーターをつないだもの(HF-GL、MF-GL、GL)を用意した。HF456はヒトc-fosプロモーターをちょうどhHSEfosの部分まで含むが、HF443はhHSEfosを半ばまで欠失させており、またmHF456はhHSEfosの3つのGAA/TTCブロックに変異を導入したものである。HF-GLおよびMF-GLは親プラスミド(GL)のSV40プロモーターの上流に各々hHSEfosあるいはmHSEfosを挿入したものである。これらのレポータージーンを内部標準プラスミドとともにMCF-7細胞に導入し、2日後にストレス(43℃,1時間の熱ショックの後37℃で2時間培養、ないしは50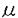 M亜砒酸,6時間、ないしは100 M亜砒酸,6時間、ないしは100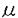 Mカドミウム,6時間)を加えて、加えなかった場合に比してホタルルシフェラーゼ活性が何倍上昇するかを調べた。その結果、intactなhHSEfosないしはmHSEfosを有するレポータージーン(HF456、HF-GL、MF-GL)では、著しい上昇が見られ、有さないレポーター(HF443、mHF456、GL)に比べて明らかに有意差があった。これらの結果によりhHSEfosおよびmHSEfosはHSEとして機能していることが確実となった。 Mカドミウム,6時間)を加えて、加えなかった場合に比してホタルルシフェラーゼ活性が何倍上昇するかを調べた。その結果、intactなhHSEfosないしはmHSEfosを有するレポータージーン(HF456、HF-GL、MF-GL)では、著しい上昇が見られ、有さないレポーター(HF443、mHF456、GL)に比べて明らかに有意差があった。これらの結果によりhHSEfosおよびmHSEfosはHSEとして機能していることが確実となった。 以上、本論文は、これまでの定説を覆して、c-fos遺伝子上流に確かにHSEが存在することを証明した。HSEは本研究で用いられたストレス以外にも、多くの刺激(虚血・再灌流、酸化ストレス、低酸素など)に反応して転写を亢進させることが知られているため、本研究は様々な生理的・病的な状態におけるc-fos発現亢進の機序の解明に重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 |