全身性エリテマトーデスや混合性結合組織病などの全身性自己免疫疾患は、自己抗体の出現を特徴としている。通常、これらの自己抗体は、核内抗原であるヌクレオソームやスプライソゾームの構成成分などの全身性に発現する臓器非特異的自己抗原を認識する抗体であり、自己抗原特異的T細胞の関与が示唆されている。全身性自己抗原に対するT細胞トレランスの成立に関しては、幾つかの全身性自己抗原反応性T細胞レセプター発現トランスジェニックマウスを用いて研究され、胸腺におけるクローン除去が最も重要であることが示されている。しかし、最近の研究では、全身性自己抗原反応性T細胞は健常人の末梢にも存在していることが示されており、この事は、例えば微生物の感染が生じた場合、molecular mimicryやスーパー抗原などの機序により自己反応性T細胞が増幅し、自己免疫疾患の発症へと進展する可能性があることを示唆している。従って、全身性自己抗原に対する免疫学的寛容の維持には、中枢のみならず末梢における制御も重要であると考えられる。 これまで、組織特異的プロモーターを用い胸腺外に新たな抗原を発現させたトランスジェニックマウスで、クローン除去やT細胞表面のT細胞レセプターの発現低下などの幾つかの機序が、臓器特異的な自己抗原に対する末梢性トレランスの機構として示された。同様の所見、すなわち一過性の活性化後のクローン除去や不応性は、細胞移入を用いた全身性自己抗原に対する末梢性トレランスの研究においても最近報告されている。しかし、実際の疾患で認められる核内抗原に対する自己免疫応答の末梢における制御や病態への関与に関しては不明である。これらを明らかにするため、核内自己抗原発現トランスジェニックマウスを作成し、その末梢へ自己抗原反応性リンパ球を移入して解析を行った。 抗原の発現組織や細胞内局在、他の分子との結合は、抗原特異的免疫反応に重大な影響をもたらすと考えられるため、クラスIプロモーター下に、ヒトU1 snRNP-A蛋白(HuA)を発現する核内自己抗原発現トランスジェニックマウスを作成した。U1 snRNPは、スプライソゾームを構成するUタイプリボ核酸蛋白複合体(U snRNPs)の一つであり、その構成要素であるU1A、70K、U1C蛋白は、SLEの20〜30%やMCTDのすべてで認められる抗RNP抗体の主要な認識抗原である。マウスに蛋白免疫によりHuAに対する免疫応答を誘導できる事や、マウスU snRNP複合体に対する免疫応答はmuAから始まる事などがこれまで示されている。 まず、トランスジェニックマウスにおける導入遺伝子産物HuAの発現について検討した。発現は、脾臓細胞、胸腺細胞、末梢血単核球で確認することができた。次に、細胞内の発現局在を知るため、脾臓細胞を細胞質分画と核分画に分離しウェスタンブロッティングを施行したところ、HuAは主に核内に発現している事が明らかになった。更に、HuAがマウスU snRNP複合体に組み込まれているかどうかを調べるため、U snRNAのキャップ抗体である抗2,2,7トリメチルグアノシン抗体を用いて核分画の免疫沈降を施行したところ、HuAがマウスU snRNP複合体を構成していることが明らかになった。従って、導入遺伝子産物の発現組織や細胞内局在、他の分子との結合ともに生理的であり、自己抗体の進展などの核内抗原に対する自己免疫応答について検討するのに適切なモデルと考えられた。また、二つのトランスジェニックラインを得たため、導入遺伝子の発現レベルを比較した。両ラインよりB細胞を分離し、同数の細胞から調整した全細胞抽出液を用いて内因性に発現しているmuAに対する導入遺伝子産物であるHuAの発現量の割合を比較した結果、HAB64ラインは高発現ラインであり、HAB69ラインは低発現ラインであると考えられた。 トランスジェニックマウスのHuAに対する反応について検討した。リコンビナントHuA/complete Freund’s adjuvant(CFA)を免疫し、ELISAによる抗HuAIgG抗体価の測定および免疫10日後のHuAに対するリンパ球増殖反応を観察したところ、野生型マウスと異なりB及びT細胞反応とも有為な応答を示さなかった。 トランスジェニックマウスに自己反応性リンパ球を導入しその制御や病態への関与を観察するため、野生型マウスにリコンビナントHuA/CFAを免疫して得られた脾細胞、すなわちHuA反応性リンパ球をトランスジェニックマウスの末梢に移入した。その後、経時的に血清を採取し、ELISAで抗HuA IgG抗体価を測定した。トランスジェニックマウスおよび野生型マウスの両者で、ほぼ同程度の抗HuA IgG抗体の産生が認められ、6カ月以上の経過で徐々に低下していった。抗体価は、移入した細胞数に伴って異なり、導入遺伝子の有無による抗体価やその推移の差は認められなかった。 トランスジェニックマウスに自己抗体産生を誘導することができたが抗体価は高値でなかったため、自己抗体産生に伴う病態を解析するために、メモリー反応を惹起し自己反応性リンパ球の増幅を試みた。細胞移入の約3カ月後にレシピエントにHuA/incomplete Freund’s adjuvant(IFA)を注射したところ、低発現ラインであるHAB69では、抗HuA IgG抗体の産生はブースターにより亢進し、野生型とほぼ同等の抗体価および変動を示した。しかし、ブースターの約3カ月後より野生型に比し著明な蛋白尿を呈するようになり、腎臓の病理組織学的検討より免疫複合体沈着型糸球体腎炎と考えられた。また、自己抗体の産生が、intermolecular/intrastructual helpを介して、自己抗原と複合体を形成している他の構成要素へと進展することが知られており、HuAトランスジェニックマウスは、HuA導入遺伝子産物がマウスU1 snRNP複合体に組み込まれていることから、この現象の研究によいモデルであると考えられた。そこで、HAB69マウスが、U1A蛋白からU1 snRNP複合体の構成要素の一つである70Kへの自己免疫応答の進展を検討した。70Kに対する自己抗体が検出され、U1A蛋白に対する自己免疫応答の惹起により、intermolecular/intrastructual helpを介して自己抗原複合体の他の構成要素へ自己免疫応答が進展することが明らかになった。 一方、高発現型であるHAB64では、細胞移入後のHuA/IFAによるブースターを施行後の抗HuA IgG抗体の上昇は著明に抑制された。細胞移入後直ちにブースターを施行しても同様の抗体価の上昇は抑制されたことから、activation induced cell deathではなく他の制御機構が働いている可能性を考え、調節性細胞の存在を検討した。細胞移入後HuA/IFAでブースターを施行したトランスジェニックマウスおよびポジティブコントロールとして野生型マウスから、調節性細胞を含むと考えられる脾細胞を調整し、HuA/CFAを免疫した野生型マウスの脾細胞(反応細胞)およびHuAとともに混合し、in vivoでのDTH反応及びin vitroで反応細胞のHuAに対する増殖反応の阻害の有無を観察した。この結果、細胞移入後HuA/IFAでブースターを施行したトランスジェニックマウスの脾細胞に、HuA反応性細胞によるDTH反応や増殖阻害反応を阻害する調節性細胞が存在する事がわかった。次に、どの細胞により増殖阻害反応が起きているのかを検討するために、調節性細胞を含むと考えられる細胞群より、T細胞もしくはB細胞を除去して同様の増殖阻害反応の有無を観察した。抗Thy1.2抗体陽性細胞群を除去した場合、増殖阻害反応は認められなくなったので、調節性T細胞がこの阻害に関連していると考えられた。また、抑制性サイトカインに対する中和抗体存在下にproliferation inhibition assayを施行した。IL-4、IL-10、TGF-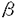 に対する中和抗体の投与では抑制効果の消失は認められなかった。従って、少なくともこれら抑制性サイトカインが主に関与している可能性は低いと考えられた。 に対する中和抗体の投与では抑制効果の消失は認められなかった。従って、少なくともこれら抑制性サイトカインが主に関与している可能性は低いと考えられた。 以上をまとめると、導入遺伝子産物の発現量の異なる2つのHuAトランスジェニックラインを得た。野生型マウスにHuAを免疫する事により得られたHuA反応性リンパ球をHuA発現トランスジェニックマウスに移入し、更にその後ブースターにより自己反応性リンパ球の増幅をはかった。この結果は、発現量の異なる2つのラインで異なった。低発現ラインでは、核内自己抗原であるHuA蛋白への自己免疫応答により、自己抗体産生の増幅とともに、他のU snRNPの構成要素への自己免疫応答の進展と糸球体腎炎の発症が認められた。一方、高発現ラインでは、T細胞が関与するHuA蛋白に対する自己免疫応答の抑制が認められ、核内自己抗原への免疫応答に対して末梢は調節機構を有することが示唆された。以上の如く、自己抗原の発現量の違いにより作動状況の異なる自己に対する免疫応答の制御機構の存在および核内自己抗原に対する免疫応答の病態への関与を明らかにした。また、我々の樹立したトランスジェニックマウスモデルは、導入遺伝子産物の局在や他の分子との作用の点で、通常の生体で認められるU1A蛋白の状況と同様であることより、SLEやMCTDなどの全身性自己免疫疾患の理解と治療に今後、重要な情報を供与できるものと考えられる。 |