本研究は、インターフェロン系を制御する転写因子であるIRF-1およびIRF-2の免疫系細胞における機能、特にTh1/Th2型細胞分化における機能を明らかにするために、T細胞レセプタートランスジーンを導入することにより解析し、下記の結果を得ている。 1.T細胞レセプタートランスジーンを導入したIRF-1-/-マウス脾細胞に、抗原ペプチドを加えin vitroでTh1/Th2型細胞分化の誘導を行い解析した結果、野生型マウスがTh1型細胞分化が誘導されるのに対し、IRF-1-/-マウスではTh2型細胞分化が誘導された。すなわちIRF-1はTh1型細胞分化の誘導に寄与する転写因子であることを明らかにした。 2.Th1型細胞分化を誘導するサイトカインであるIL-12p40サブユニットの遺伝子発現誘導を解析し、IRF-1-/-マウス脾細胞では、LPSおよびIFN-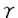 による誘導に加え、CD40による誘導も著明に低下しており、IRF-1はCD40によるIL-12産生に必須の転写因子であることを示した。また、IRF-1-/-抗原提示細胞の機能を調べた結果、IRF-1-/-抗原提示細胞が野生型CD4+T細胞をTh2型細胞に分化誘導すること、すなわちIRF-1-/-抗原提示細胞に機能異常があることを明らかにした。 による誘導に加え、CD40による誘導も著明に低下しており、IRF-1はCD40によるIL-12産生に必須の転写因子であることを示した。また、IRF-1-/-抗原提示細胞の機能を調べた結果、IRF-1-/-抗原提示細胞が野生型CD4+T細胞をTh2型細胞に分化誘導すること、すなわちIRF-1-/-抗原提示細胞に機能異常があることを明らかにした。 3.IRF-1-/-CD4+T細胞は野生型のそれと比較し、Th1型細胞への分化の程度が低下していることを初めて示した。 4.以上より、IRF-1は抗原提示細胞およびCD4+T細胞の両方の細胞群において、Th1型細胞分化に寄与する転写因子であることを示し、そのメカニズムの1つとして、IRF-1がIL-12p40産生を制御することを明らかにした。 5.IRF-1に拮抗作用を持つとされるIRF-2のTh1/Th2型細胞分化における役割についても解析した。IRF-1-/-マウスの場合と同様に、T細胞レセプタートランスジーンを導入したマウスを解析した結果、IRF-2-/-マウス脾細胞ではTh2型細胞分化が誘導されること、すなわち、IRF-2はTh1/Th2型細胞の分化に関し、IRF-1に拮抗するのではなく、むしろIRF-1と同様にTh1型細胞分化の誘導に寄与する転写因子であることを明らかにした。 6.IRF-2-/-マウス脾細胞の機能異常の原因を明らかにするために、IRF-2-/-抗原提示細胞およびIRF-2-/-CD4+T細胞の機能を解析した。その結果、IRF-2-/-抗原提示細胞が野生型CD4+T細胞をTh2型細胞に分化誘導すること、IRF-2-/-CD4+T細胞のサイトカイン産生は野生型と同様であることを示し、その機能異常が主に抗原提示細胞の機能異常に由来することを明らかにした。 7.IRF-2-/-マウス脾細胞の機能異常の原因について、どのような分子の発現異常によるものか検討したが、検索した範囲では、野生型と比較し、機能異常が著しいものは見いだせなかった。一方、IRF-2-/-マウス脾細胞ではI型インターフェロンシグナルが増強しており、I型インターフェロンの細胞内情報伝達分子であるISGF3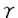 を同時に欠損するマウスでは、Th1/Th2型細胞分化の異常は正常に回復した。このことから、IRF-2-/-マウス脾細胞のTh1/Th2型細胞分化異常はI型インターフェロンシグナルの増強によることが明らかとなった。 を同時に欠損するマウスでは、Th1/Th2型細胞分化の異常は正常に回復した。このことから、IRF-2-/-マウス脾細胞のTh1/Th2型細胞分化異常はI型インターフェロンシグナルの増強によることが明らかとなった。 以上、本論文は、IRFファミリー転写因子に属するIRF-1およびIRF-2の遺伝子欠損マウスにT細胞レセプタートランスジーンを導入することにより、これらの転写因子がインターフェロン系だけではなく、Th1/Th2型細胞分化をも制御することを明らかにした。このように本研究はIRFファミリー転写因子の新しい機能を明らかにし、またTh1/Th2型細胞分化の機序の解明にも貢献するものと考えられ、学位の授与に値するものと考えられる。 |