本研究は生体内で多彩な作用をしているエストロゲンの機能をより深く理解するためにエストロゲン受容体が特異的に結合するゲノムDNAを単離する方法(Genomic binding-site cloning法)により新たなエストロゲン応答遺伝子EREG1(Estrogen Responsive Element associated Gene 1)をクローニングし、その解析を試みたものであり、以下の結果を得ている。 1.Genomic binding-site cloning法により得たゲノムDNA断片(E1 fragment)をプローブとして用いて、HeLa細胞のcDNAライブラリよりcDNAをクローニングし、全長のシークエンスを決定した。この遺伝子は新規遺伝子であり、cDNAの全長は約1.7kbで、シークエンスから予測される最長のOpen Reading Frame(ORF)は100bp-841bpで247アミノ酸をコードしていると予測された。E1 fragmentの全長は3’非翻訳領域内に存在しており、perfect palindromic ERE(estrogen responsive element)も存在していた。 2.EREG1のcDNAをプローブとしたNorthern blot法により、2-kbのtranscriptがhumanの大腸、脾臓、ヒト子宮由来の細胞株(HeLa細胞、HHUA細胞、ISHIKAWA細胞)に、また、6-kbのtranscriptが脾臓、大脳、末梢血リンパ球に認められた。同じくEREG1のcDNAをプローブとしてhumanのゲノムDNAを用いたSouthern blotを行ったところ、single geneを示唆するような結果が得られているので、humanの臓器・細胞株のNorthern blotで認められた複数の長さのバンドはalternative splicingによるものと考えられる。 3.予測されるアミノ酸配列を用いて、データベースサーチをしたところ、Caenorhabditis elegansの遺伝子であるEEED8.8のコードする蛋白に高い相同性があることが分かった。EREG1とEEED8.8のidentityとsimilarityはそれぞれ28%と39%であった。EEED8.8はC.elegansのゲノムプロジェクトにより見いだされた遺伝子であり、その機能は未だ分かっていない。アミノ酸配列で保存されている領域が2カ所認められ、この部位は機能は不明であるが、何らかの機能を持ったドメインであると考えられる。さらに興味深いことに、EREG1とEEED8.8のアミノ酸配列にはMutTコンセンサスモチーフが存在していることが分かった。これは大腸菌のmutator遺伝子であるmutTに認められる配列で、このモチーフを持つ一群の遺伝子群はMutT familyと呼ばれ、核酸の代謝に関与していると考えられている。EREG1とEEED8.8もこのfamilyの持つ機能を持っているものと考えられる。 4.EREG1の3’UTRにあるperfect palindromic EREにエストロゲン依存性エンハンサー活性があるかどうか調べるため、CAT assayを行った。CAT assay法により、EREG1のEREには約3倍のエストロゲン依存性のエンハンサー活性が認められた。さらに、EREG1のエストロゲン応答性を確認するため、エストロゲン受容体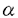 (ER (ER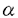 )を定常的に発現するHeLa細胞を構築した。この新たに構築した細胞にエストロゲンを添加しNorthern blotを行いエストロゲン応答性を確認した。エストロゲンにより、8時間後に約3.7倍の発現の増加が認められ、EREG1 mRNAがエストロゲンにより、転写が調節されていることを示した。 )を定常的に発現するHeLa細胞を構築した。この新たに構築した細胞にエストロゲンを添加しNorthern blotを行いエストロゲン応答性を確認した。エストロゲンにより、8時間後に約3.7倍の発現の増加が認められ、EREG1 mRNAがエストロゲンにより、転写が調節されていることを示した。 5.EREG1のcDNAをプローブとして、独立したゲノムクローンを2個単離し、シークエンスにて確認した。これらを用いて、Fluorescence in situ hybridization(FISH)法による染色体マッピングを行ったところ,EREG1の遺伝子は21q22.2-22.3に存在することが分かった。この領域付近にはダウン症候群、bipolar disorder、myoclonus epilepsyの責任領域があり、これらの疾患へのEREG1の関与の可能性が考えられた。 以上、本論文は新たなエストロゲン応答遺伝子をクローニングし、その解析により、MutT family属する遺伝子であることが示された。生体内で多彩な作用を示すエストロゲンの機能の解明に重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 |